Artículos Originales
Prevalencia de neuropatía periférica dolorosa y asintomática de un programa de tamizaje para riesgo de pie diabético en un hospital público peruano
Prevalence of painful peripheral neuropathy in a screening program looking at risk for developing diabetic foot in a public Peruvian hospital
Prevalencia de neuropatía periférica dolorosa y asintomática de un programa de tamizaje para riesgo de pie diabético en un hospital público peruano
Acta Médica Peruana, vol. 41, núm. 2, pp. 92-102, 2024
Colegio Médico del Perú

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
Recepción: 26 Febrero 2024
Aprobación: 22 Mayo 2024
Resumen: Objetivo: determinar la prevalencia de la neuropatía periférica (NP) dolorosa y asintomática en personas con diabetes mellitustipo 2 (DM2) y sus características asociadas. Materiales y métodos: estudio transversal-descriptivo de pacientes del programa de pie en riesgo del Servicio de Endocrinología del Hospital Nacional María Auxiliadora (HMA). Se incluye a pacientes con DM2 atendidos entre el 2015 y el 2020. La definición de NP fue según el Consenso de Toronto, que considera la evaluación de tres componentes: síntomas, signos y reflejo aquíleo, calificando la certeza como posible y probable, según su combinación. Para la evaluación de síntomas se aplicó el puntaje total de síntomas (TTS, del inglés Total Symptom Score); para los signos se usó la prueba de monofilamento y se evaluó la sensibilidad vibratoria con diapasón de 128 Hz. La prevalencia de NP se calculó según sintomatología y la certeza del diagnóstico. Además, se describieron las características clínicas entre los grupos. Resultados: se incluyó a 1006 personas con una edad media de 60,5 años, de las cuales el 69,3% correspondió a mujeres. En aquellos que tenían al menos un criterio de Toronto (neuropatía posible y probable), un 60,5% presentó NP dolorosa y un 21,8% NP asintomática. Utilizando una mayor certeza diagnóstica, es decir, dos de tres criterios positivos (solo neuropatía probable), la prevalencia de NP dolorosa fue del 42,2% y la NP asintomática, 6,5%. Se establecieron cuatro grupos que presentaron distribuciones diferentes respecto a sexo, tiempo de diabetes, antecedente de úlcera, enfermedad arterial periférica y control glicémico. Conclusión: en pacientes del Servicio de Endocrinología del HMA, el 42,2 y el 6,5% presentaron una mayor certeza de presentar NP probable dolorosa y asintomática respectivamente. Se requiere estudios que confirmen la utilidad de estos criterios para estimar correctamente la carga de enfermedad.
Palabras clave: Diabetes Mellitus Tipo 2, Neuropatías Diabéticas, Estudios Transversales, Servicio Ambulatorio en Hospital, Prevalencia, Fenotipo.
Abstract: Objective: To determine prevalence of painful asymptomatic peripheral neuropathy (PN) in persons with type 2 diabetes mellitus (DM2) and its associated characteristics. Materials and Methods: This is a cross-sectional descriptive study performed in patients belonging to the program ‘Feet at risk’ at the Endocrinology Service in Maria Auxiliadora National Hospital. Patients with DM2 who were seen between 2015 and 2020 were included. The definition of PN is according to Toronto Consensus, considering the evaluation of three components: symptoms, signs and Achilles reflex, determining certainty as possible and probable, according to the combinations found. For assessing symptoms, the total symptom score (TTS) was used; for signs, monofilament test was used, and vibration sensitivity was assessed using a 128-Hz tuning fork. Prevalence of PN was calculated according to symptoms and certainty of the diagnosis. Also, the clinical characteristics of patient groups were described. Results: One-thousand and six persons were included, their mean age was 60,5 years, and 69,3% were female. In those who had at least one item from Toronto criteria, 60,5% had painful PN, and 21,8% had asymptomatic PN. When using more diagnostic certainty, i.e., two from three criteria being positive, the prevalence of painful PN was 42,2% and for asymptomatic PN, it was 6,5%. Four groups with different distributions with respect to sex, time with diabetes, ulcer history, peripheral arterial disease and glycemic control were established. Conclusion: In patients from the Endocrinology Service at Maria Auxiliadora Hospital 42,2% and 6,5% had more certainty for presenting with probable painful PN and asymptomatic PN, respectively. Further studies are needed for confirming the usefulness of the aforementioned criteria for properly estimating the burden of disease.
Keywords: Diabetes Mellitus, Type 2, Diabetic Neuropathies, Cross-Sectional Studies, Outpatient Clinics, Hospital, Prevalence, Phenotype.
INTRODUCCIÓN
A nivel mundial, la prevalencia de diabetes mellitustipo 2 (DM2) ha duplicado sus cifras en los últimos 35 años y ya es considerada un importante problema de salud pública. Origina múltiples complicaciones y el 50% de afectados muere por causa cardiovascular [1].
Una de sus complicaciones más frecuentes es la neuropatía periférica (NP), calculándose que tiene una prevalencia mundial del 34,5% [2] y del 46,7% [3] para América Latina y el Caribe. En el Perú, un estudio realizado en un hospital nacional de Lima reportó una prevalencia del 17% al momento del diagnóstico [4]. Esta complicación se encuentra en dos de cada tres diabéticos siendo el principal factor de riesgo de úlcera y amputación [5].
La NP es influenciada por la hiperglucemia crónica y otras vías bioquímicas que provocan estrés oxidativo, apoptosis neuronal y alteración de la permeabilidad neurovascular; mecanismos que deben ser revertidos a través de la aplicación de un tratamiento metabólico integral que controle la glicemia, lípidos y presión arterial [6]. Inicialmente, la NP afecta a las fibras nerviosas pequeñas, provocando parestesias y, finalmente, se afectan las fibras largas mielinizadas, encargadas de la sensibilidad propioceptiva, los reflejos y la acción motora [7].
El fenotipo doloroso de la NP usualmente precede a la insensibilidad y se asocia al género femenino, mala calidad de vida, deficiente control glicémico e insomnio; mientras que la NP asintomática se asocia a úlcera y amputación mayor. No obstante, en algunos pacientes, la molestia persiste a pesar de tener ya un severo daño neuronal cuando debería estar abolida [8]. Esta presentación variada podría estar vinculada con la regulación
del flujo sanguíneo periférico; por ejemplo, este se encuentra alterado en pacientes con NP dolorosa comparado con aquellos con NP asintomática. Además, otros factores como la edad avanzada, inactividad física, obesidad, hipertensión y factores genéticos influirían en la persistencia de la NP dolorosa [9].
Desde hace 30 años existen esfuerzos para jerarquizar esta forma de diagnosticar según la certeza de la prueba utilizada, entre los cuales se encuentra el consenso de Toronto [10]. A pesar de tener esta guía, aún existe una elevada variabilidad respecto al examen a escoger en forma individual o combinada para evaluar fibras largas o cortas. Así como la forma de aplicación y establecer umbrales para indicar anormalidad.
Localmente, más de la mitad de los pacientes con debut de diabetes presentan NP y los controles glicémico y metabólico alcanzan el 33 y 12% de pacientes, "respectivamente [4]. Que condicionaría una carga de enfermedad de los diferentes fenotipos de NP. Por tanto, nuestro objetivo fue determinar la prevalencia de los diferentes fenotipos de NP (dolorosa y asintomáticas) y describir sus características asociadas, en pacientes que acuden por primera vez a un programa preventivo de pie diabético en un hospital público del Ministerio de Salud del Perú (Minsa).
MATERIALES Y MÉTODOS
Diseño del estudio y escenario clínico
Trabajo transversal descriptivo desarrollado con base a la revisión de fichas clínicas del Programa de pie en riesgo del Servicio de Endocrinología, de pacientes atendidos entre los años 2015 y 2020 en el Hospital Nacional María Auxiliadora (HMA), ubicado en el distrito de San Juan de Miraflores, provincia y departamento de Lima. Los autores accedieron a las fichas de julio a diciembre del 2022.
Población y muestra
La población estuvo conformada por las fichas clínicas de los pacientes con DM2 evaluados en el programa de pie en riesgo y que fueron derivados de la consulta externa de endocrinología. Estos pacientes son referidos de los centros de salud de los distritos de Lima Sur que mayormente con cuentan con aseguramiento subsidiado (Seguro Integral de Salud). Excluimos a aquellas que presentaron registro de una amputación mayor de miembro inferior, antecedente de hipotiroidismo sin tratamiento, enfermedad renal crónica en hemodiálisis, diagnóstico de diabetes mellitus tipo 1, y antecedente de ictus o de lesiones periféricas neurológicas compresivas, como hernia del núcleo pulposo. Se realizó un muestreo no probabilístico censal de todas las personas con fichas con datos completo de la evaluación neurológica.
Variables
Utilizamos el Consenso de Toronto que establece una jerarquía para diagnosticar la NP basado en tres criterios: síntomas, signos y reflejo aquíleo. Permite clasificar a la NP como posible (si es positivo solo a alguno de los tres criterios) o probable (si fue positivo a dos de tres criterios, siendo excluyentes) [10].
Para los signos evaluamos si presentó alteración en la prueba de monofilamento de 10 g (sí, no); alteración en el diapasón (sí, no) y alteración del reflejo aquíleo (sí, no) [11]. La presencia de síntomas fue medida por el Total Symptom Score (TSS). El TSS estima la intensidad y frecuencia de ardor, hormigueo, parestesia y adormecimiento, y usa una escala de valoración individual que va del 0 (ausencia de síntomas) a 3,66 (máxima intensidad y frecuencia de síntomas); el puntaje total corresponde a la suma de las cuatro valoraciones individuales (rango de 0 a 14,64) [12]. Para determinar la presencia o no de síntomas, usamos el punto de corte de 2 (dolor negativo < 2, dolor positivo ≥ 2) [13].
En la Figura 1 presentamos el algoritmo diagnóstico utilizado y se describe el nivel de certeza para NP dolorosa y NP asintomática, respectivamente [14].
Otras variables que se midieron fueron el género (masculino, femenino); edad (<60 años; 61 a 74,9; 75 a más); grado de instrucción (iletrado, primaria, secundaria, superior); tiempo con diagnóstico de DM2 (< 10 años; 10 a 19,9 años; 20 a más años); tratamiento de diabetes (solo dieta, solo antidiabético oral, antidiabético oral con o sin insulina, solo insulina); medicación para tratar la neuropatía (sí, no); presencia de úlcera pedia previa y actualmente epitelizada (sí, no); antecedente de retinopatía (sí, no); antecedente de hipotiroidismo en tratamiento (sí, no); antecedente de enfermedad coronaria (sí, no); antecedente de hipertensión arterial (sí, no); número de evaluaciones en el programa de pie en riesgo (único, 2, 3 o más); índice de masa corporal (menor de 25 kg/m2; 25 a 29,9 kg/m2; 30 a más kg/m2); enfermedad arterial periférica (EAP) por pulso ausente o índice tobillo brazo (ITB) menor a 0,9 según el ITB más bajo (sí, no); enfermedad renal crónica definida como tasa de filtración glomerular calculada por fórmula CKDEPI menor a 60 mL/min (sí, no); control glicémico (valor de hemoglobina glicosilada menor a 7% [sí, no]), y control metabólico (hemoglobina glicosilada menor a 7%, LDL colesterol menor a 100 mg /dL, y presión arterial sistólica menor a 140 mm Hg [sí, no]).
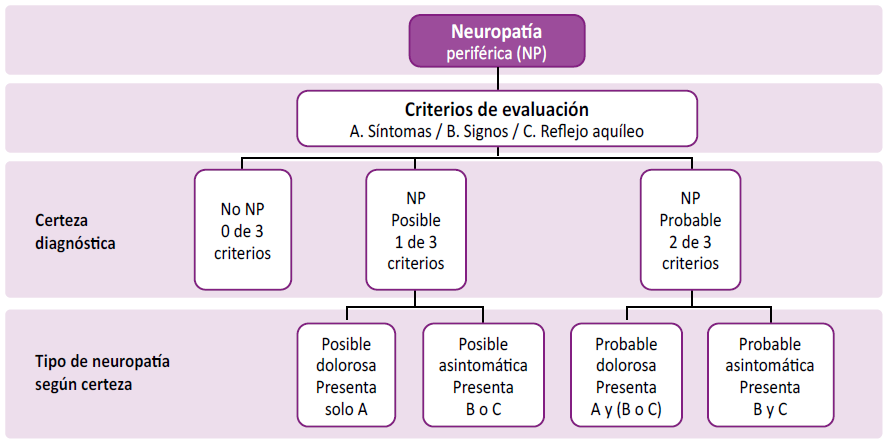
Figura 1.
Flujograma diagnóstico jerárquico de neuropatía periférica (NP).
Flujo de trabajo que permite determinar el tipo de presentación de la NP (posible dolorosa, posible asintomática, probable dolorosa y probable asintomática) según el Consenso de Toronto.
Procedimientos
El programa de pie en riesgo está activo desde el año 2015. Este programa estratificó y asignó un cronograma a todos las personas incluidas. Los criterios de positividad que usó estuvieron basados en los del Grupo Internacional de Trabajo de Pie Diabético [11]. La evaluación fue realizada por dos médicos endocrinólogos y tuvo una duración de 30 min.
El programa de pie en riesgo realizó la evaluación de NP de la siguiente manera: se evaluaron los síntomas y se usó el TSS para determinar la presencia de dolor, así como la intensidad y frecuencia e intensidad de este, si fuese el caso. Además, se consideró como paciente con dolor positivo a aquel caso en el que, a pesar de tener un valor de TSS menor a 2, presentaba antecedentes de estar tomando medicación para tratar la NP [12,13].
La prueba de monofilamento fue aplicada en cuatro zonas plantares de cada pie (cabeza de primer, tercero y quinto metatarsiano y zona plantar de primer dedo). Se consideró como resultado positivo si alguna zona de las ocho zonas evaluadas no fue detectada por el paciente. La sensibilidad vibratoria fue medida en el primer ortejo de ambos pies, con el diapasón 128 Hz. El resultado fue positivo si el paciente no percibía el estímulo, o lo hacía en forma disminuida, en alguno de los dos pies. Para el reflejo aquíleo, el paciente estuvo de rodillas en una silla según técnica estándar. El resultado fue considerado positivo si el paciente presentaba una respuesta ausente o demorada en alguno de los pies [11].
Para este estudio, los autores revisaron las fichas clínicas en medio físico y se siguió un flujograma de selección (Figura 1) según los criterios de elegibilidad descritos anteriormente [14]. Para asegurar un mejor rendimiento de los valores de laboratorio y registros se optó por considerar la última ficha de cada paciente en el periodo referido. Si aún hubiese algún dato de laboratorio incompleto, se extrajo el valor requerido del sistema de laboratorio del hospital, correspondiente a la ficha evaluada. Los datos fueron digitados en una hoja de cálculo.
Plan de análisis
Para el análisis se utilizó el software STATA ® V16.0. Las variables cualitativas se describieron en frecuencias y porcentajes, las variables cuantitativas con media con desviación estándar o mediana con rango intercuartílico, según normalidad. Basado en el Consenso de Toronto, según presente NP dolorosa y asintomática, se obtuvieron cinco grupos: no NP, NP posible dolorosa, NP posible asintomática, NP probable dolorosa y NP probable asintomática.
Para calcular la precisión de la muestra a fin de estimar la prevalencia de NP, utilizamos el programa EPIDAT 4, considerando una población de 1006 fichas, una confianza del 95% y una prevalencia de NP esperada del 46,7% [3], obteniendo una precisión del 3,5%.
Aspectos éticos
Esta investigación fue aprobada por el Comité Institucional de Ética e Investigación del Hospital María Auxiliadora con el código HMA/CIEI/0033/2021.
RESULTADOS
Entre enero del 2015 y febrero del 2020 se registraron 1019 pacientes del programa de pie en riesgo. Después de excluir a quienes registraban antecedente de amputación mayor, ictus y diabetes mellitustipo 1, quedaron 1006 personas (Figura 2).
La muestra presentó una edad media de 60,5 años (rango 34 a 95 años) y el 69,3% correspondió a mujeres. Se registró una mediana de tiempo de enfermedad de DM2 de siete años y el 35,5% usaba como tratamiento insulina sola o en combinación con antidiabéticos orales. Asimismo, un 20,4% tomaba medicación para el dolor de tipo neuropático en los últimos tres meses. Entre las comorbilidades más importantes, el 28,9% tenía hipertensión arterial. Respecto a complicaciones de la DM2, un 9% presentaba antecedente de úlcera al igual que retinopatía y un 16% enfermedad renal crónica.
Según el resultado del TSS, el 60% presentó síntomas significativos, lo que equivale a obtener un puntaje mayor o igual a 2, siendo el adormecimiento el síntoma más común con un 33%. De las pruebas neurosensoriales, la prueba alterada con mayor frecuencia fue la del diapasón con 39%, seguida por la de monofilamento con 36%, y el 30,4% presentó dos o más alteraciones. Respecto al examen vascular, el ITB estuvo registrado en solo 742 pacientes, de los cuales el 26,9% presentó un ITB < 0,9. Respecto al control de las metas metabólicas, solo el 21% presentó una hemoglobina glicosilada (HbA1c) menor a 7%. Cuando se evaluó la meta integral de un valor de HbA1c menor a 7% más LDL menor a 100 mg/dL y presión arterial sistólica menor a 140 mmHg, solo el 4% lo presentó (Tabla 1).
En la Tabla 2 se presenta la prevalencia de NP según la certeza del diagnóstico. El 82,3% la presentó en forma aislada o en combinación de síntomas, signos o reflejo aquíleo alterado. El 60,5% presentó NP dolorosa y el 21,8% NP asintomática. Al requerir una mayor certeza diagnóstica, es decir dos de tres criterios de Toronto, la prevalencia de NP dolorosa fue del 42,2% y del 6,5% para NP asintomática (Tabla 2).
En la Tabla 3 describimos los cuatro patrones o fenotipos de NP (posible dolorosa y asintomática, probable dolorosa y asintomática) y el grupo que no tuvo alteraciones. Según el género, el 71,4% de las pacientes sin NP eran mujeres. Las NP dolorosas presentaron una distribución próxima (posible con 70,8% y probable con 81,5%). Sin embargo, en ambas NP asintomáticas este porcentaje fue menor (57,5% en posible y 47% en probable).
Se aprecia mayor tiempo de DM2 en los pacientes con NP probables (dolorosa con nueve años o asintomática 7,5 con años); mientras que en aquellos sin NP la mediana de tiempo de enfermedad fue de cuatro años.
Asimismo, hubo un mayor uso de insulina sola o en combinación en aquellos con ambas NP probables (dolorosa con 42%, asintomática con 35%) y en aquellos sin NP solo un 29% usaba insulina.
Un 28,1% del grupo sin NP presentó EAP y los grupos que tenían una mayor proporción de casos correspondía a las NP probables, a asintomática con 56,1% y la dolorosa con 44,7%. El grupo sin NP solo presentó un 28% de casos con EAP.
Respecto al antecedente de úlcera, las NP probables tuvieron el mayor porcentaje (NP asintomática con 21,2% y NP dolorosa con 14,6%). El grupo sin NP no presentó algún registro.
Además, hallamos una mayor frecuencia de enfermedad renal crónica en las NP dolorosas (NP probable con 20,9 % y NP posible con 20 %) mientras que el grupo sin NP era de 9,6%.
Solo el 28,9% de los pacientes sin NP presentaron una HbA1c menor al 7%. Las NP dolorosas tuvieron el menor porcentaje, la posible con 22,7% y la probable con 13,9%.
La media de edad, índice de masa corporal, las proporciones de grado de instrucción, antecedente de hipertensión arterial, antecedente de retinopatía, triglicéridos y control metabólico fueron similares entre los cinco grupos (Tabla 3).
DISCUSIÓN
Nuestro estudio utilizó el Consenso de Toronto, que establece una jerarquía en el diagnóstico como posible o probable según el número de pruebas positivas y sus combinaciones [14]. Hallamos que el 80% de los pacientes presentó algún síntoma o signo de neuropatía periférica (NP). Según la sintomatología, el 60% presentó NP dolorosa y solo el 20% tuvo una NP asintomática. Del grupo que tuvo al menos dos de tres criterios de Toronto presentes (NP probable), el 42,2% presentó una NP dolorosa y el 6,5% una NP asintomática.
Se ha reportado anteriormente en revisiones sistemáticas la prevalencia de NP en función de los resultados de pruebas objetivas o por la presencia de dolor, pero no cómo interactúan estas dos. La revisión sistemática de Sun et al. incluyeron a 29 estudios que usaron un examen neurológico minucioso (principalmente la prueba de Michigan o pruebas de conducción nerviosa) para comprobar la NP y se encontró una prevalencia del 31,5%; no obstante, no determinó la presencia de NP dolorosa ni incluyó estudios de Latinoamérica [15].
Yovera et al., en una revisión que incluyó a 29 estudios realizados en Latinoamérica y el Caribe, encontraron una prevalencia de 46,5%, con una definición de NP basada en al menos 2 exámenes objetivos positivos. Algunos estudios incluidos describían dolor, pero no agrupaban ni describían algún tipo de NP dolorosa; asimismo, hallaron cuatro estudios realizados en Perú basados en población peruana que mostraron una prevalencia del 52%. Tres de ellos usaron monofilamento o examen físico y solo uno utilizó pruebas de conducción nerviosa [3].
Garoushi et al. evaluaron ocho estudios realizados en Medio Oriente y África del Norte y hallaron una prevalencia del 47% de NP dolorosa, basada en múltiples cuestionarios de dolor, principalmente el DN4 [16]. Van Hecke et al., analizaron estudios realizados en población general y hallaron una prevalencia de NP entre 15,3 a 72,3%, sin especificar presencia de dolor [17]. Los autores de las tres revisiones sistemáticas resaltaron la variabilidad en el diagnóstico y la necesidad de uniformizarlo.
En población con prediabetes, Kirthi et al. hallaron una prevalencia de NP del 10% [18], cifra que explica por qué esta condición es una de las más frecuentes al debut de la DM2.
El consenso de Toronto requiere evaluar fibras nerviosas periféricas largas o cortas, pero no define prioridad de evaluación, tampoco qué pruebas utilizar, ni número o combinación [10]. Nuestro estudio solo incluyó resultados de pruebas de fibras largas como el monofilamento para medir la sensibilidad protectora, diapasón para propiocepción y el reflejo aquíleo para fibras largas mielinizadas. Pero no consideró pruebas para evaluar fibras cortas como la sensibilidad al dolor, al calor o frío. Tieniendo solo para las fibras cortas, la presencia del dolor evaluado por el TSS [19].
La variabilidad de criterios se presenta incluso dentro de un mismo examen neurológico. En la prueba de monofilamento, las zonas a evaluar van de cuatro a 10 por cada pie, así como es variado el criterio para determinar alteración [20]. Nuestra data evaluó solo cuatro zonas del antepie, estrategia recomendada por guías internacionales por ser la zona de mayor porcentaje de ulceración [11]. En zonas con recursos limitados sin disponibilidad del monofilamento, incluso se recomienda el uso del dedo del evaluador para detectar sensibilidad protectora [21]. Por otro lado, el diapasón no es un instrumento de fácil acceso por su costo, siendo limitada su aplicación en tamizajes poblacionales por su pobre a moderada reproducibilidad [22].
El reflejo aquíleo alterado es uno de los signos más certeros para determinar lesión de fibra larga mielinizada, pero su medición y evaluación requiere un entrenamiento mínimo [23]. Por lo que varias guías clinicas recomiendan como tamizaje poblacional, utilizar monofilamento o diapasón [24]. Pero con fines de investigación, la aplicación de un único criterio tendría una certeza limitada y se deberían aplicar al menos dos pruebas neurológicas [25].
Presentar una prueba de monofilamento, diapasón o reflejo aquíleo alterado en pacientes con síntomas, cambia la categoría de posible dolorosa a probable dolorosa [14]. En nuestro estudio un 42,2% presentó NP probable dolorosa y un 18% presentó solo síntomas. Sin embargo, en este último grupo debería considerarse un diagnóstico diferencial o completar con otras pruebas neurológicas de fibras cortas para confirmarla [26]. El TSS es una escala que evalúa síntomas como ardor, dolor lancinante y detecta lesiones de fibras cortas y adormecimiento para lesión de fibras largas. Fue utilizado originalmente en ensayos clínicos que valoraron eficacia de tratamiento etiológicos de la neuropatía diabética [27] y actualmente, es una escala recomendada por la Asociación Latinoamericana de Diabetes (ALAD) [12].
Nuestros resultados indicarían potenciales diferencias de los fenotipos entre hombres y mujeres. Las mujeres presentaron mayor prevalencia de la NP dolorosa y los hombres mayor NP asintomática, como en otras series [28,29]. La menor proporción de dolor en el varón indicaría una mayor severidad y explicaría por qué los varones también tienen mayor incidencia de úlcera y amputación posterior [30].
Es conocido que a mayor tiempo de DM2 se esperaría mayor frecuencia de complicaciones [31]. El fenotipo que presenta mayor tiempo de DM2 son las NP con mayor certeza, resultando ser más severas. Sin embargo, también se observa una elevada prevalencia de complicaciones en pacientes con poco tiempo de enfermedad [32].
Un mal control glicémico o metabólico acelerarían altas prevalencias en menor tiempo. El control glicémico en diferentes series peruanas, representado por una HbA1c menor a 7% es de solo la tercera parte, mientras que el control metabólico integral alcanza apenas el 5% [33]. En nuestra serie, el control glicémico en pacientes sin NP fue similar a las series reportadas, pero en el grupo con NP dolorosa este control disminuyó a la mitad. Hallazgo que justifica encontrar un 50% mayor uso de insulina, comparada a aquellos con NP asintomática. Sin embargo, algunos autores reportan una neuropatía debido a insulina que aparece o se exacerba por su uso [34]. Ellos requerirían otras alternativas terapéuticas no disponibles en hospitales del Ministerio de Salud por un limitado Petitorio Nacional Único de Medicamentos Esenciales [35].
Evidenciamos, también, que solo la tercera parte tuvo tratamiento para el dolor en aquellos que lo presentaban. Muchas barreras podrían justificar estos resultados, como la dificultad de los pacientes para obtener citas, el no abastecimiento adecuado de las farmacias y el deficiente empoderamiento sobre dieta y hábitos saludables [36]. Desde el lado médico no se podría descartar la inercia terapéutica, actitud que continúa los tratamientos previamente prescritos y no hace cambios o los hace tardíamente frente a evoluciones tórpidas [37]. Multicausalidad que debe enfrentarse de forma integral y oportuna.
Importancia en salud pública
La aplicación de una jerarquía para certeza diagnóstica ordenaría la variabilidad actual. El uso de solo síntomas o de una prueba objetiva eleva las prevalencias por su potencial tasa de falsos positivos, por presencia de dolor por otras causas como fascitis, artrosis o presencia de callos. Este margen de error disminuye al realizarse dos o más veces. A nuestro juicio, un diagnóstico de NP posible debería plantearse como una condición que requiere confirmación pronta, sobre todo por examen neurológico, dado que la prueba de conducción nerviosa no es accesible y tiene un valor mayormente académico para la mayoría de los casos.
Asimismo, conocer la carga de enfermedad de la NP es crucial para la planificación y gestión de recursos humanos, medicamentos y logísticos [38]. La DM2 es una enfermedad de alto costo y su carga económica aumentará en 69% del 2015 a 2030 [39], por lo que es prioritario establecer estrategias de tamizaje como el de pie en riesgo para prevenir amputaciones. El tamizaje de la IWGDF es uno de los más extendidos en países con recursos limitados, tanto a nivel primario como en hospitales de referencia [40], cuyas intervenciones se basan en establecer un cronograma de evaluaciones y sesiones educativas según el riesgo encontrado [11].
Limitaciones y fortalezas
Nuestro estudio presenta algunas limitaciones. La prevalencia y características halladas solo son extrapolables a la población que se atiende en el Servicio de Endocrinología del HMA. Al ser una revisión de fichas, solo se pudo evaluar los factores disponibles y otras variables como hipotiroidismo, hipertensión correspondieron a autorreportes de los pacientes. Asimismo, algunos antecedentes o resultados de laboratorio no estuvieron disponibles en las fichas ni en los registros electrónicos que se buscó, por lo que muchas presentaron una tasa de registro de entre el 30% y 80%. Los médicos evaluadores del programa de pie en riesgo no contaban con una evaluación de la concordancia y exactitud en la medición; sin embargo, utilizaron una ficha estandarizada para el llenado, además, contaban con experiencia en el diagnóstico y manejo del pie diabético.
Como fortaleza, nuestro estudio abarca un número significativo de fichas de pacientes con datos clínicos con suficiente precisión para estimar prevalencias de un importante número de años.
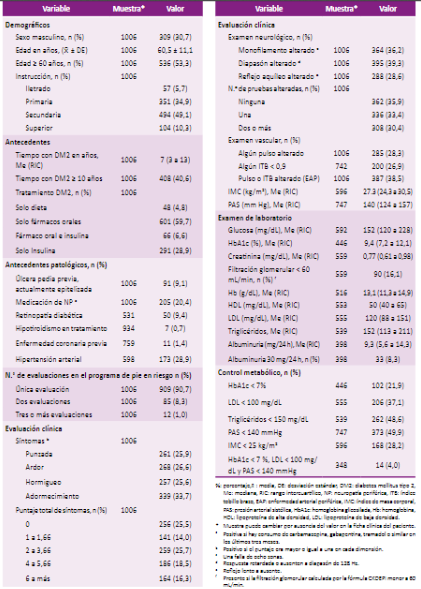
% porcentaje, : media, DE: desviación estándar, DM2: diabetes mellitus tipo 2, Me: mediana, RIC: rango intercuartílico, NP: neuropatía periférica, ITB: índice tobillo brazo, EAP: enfermedad arterial periférica, IMC: índice de masa corporal, PAS: presión arterial sistólica, HbA1c: hemoglobina glicosilada, Hb: hemoglobina, HDL: lipoproteína de alta densidad, LDL: lipoproteína de baja densidad.
* Muestra puede cambiar por ausencia del valor en la ficha clínica del paciente.
a Positiva si hay consumo de carbamazepina, gabapentina, tramadol o similar en los últimos tres meses.
b Positivo si el puntaje era mayor o igual a una en cada dimensión.
c Una falla de ocho zonas.
d Respuesta retardada o ausenten a diapasón de 128 Hz.
e Reflejo lento a ausente.
f Presente si la filtración glomerular calculada por la fórmula CKDEPI menor a 60 mL/min
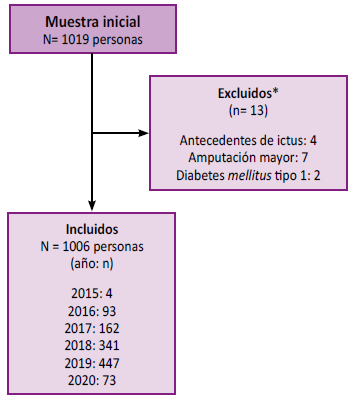
Figura 2.
Proceso de selección de los pacientes con diabetes mellitus atendidos en el Hospital María Auxiliadora 2015 -2020
* No hubo casos de pacientes con hemodiálisis, hipotiroidismo sin tratamiento, lesión periférica comprensiva o enfermedad psiquiátrica que hagan necesaria su exclusión del estudio

a Uno de los tres positivo: síntomas, signos o reflejo aquíleo alterado.
b Solo positivo para síntomas.
c Un signo positivo o reflejo aquíleo alterado, sin síntomas.
d Dos de los tres positivos: síntomas, signos o reflejo aquíleo alterado.
e Positivo para síntomas y alguno de los otros dos criterios.
f Positivo para signos y reflejo aquíleo alterado, sin dolor.
g Presencia de síntomas valorado por TSS (valor > 2), con o sin signos positivos.
j Ausencia de síntomas valorado por TSS (valor < 2), con algún signo positivo.
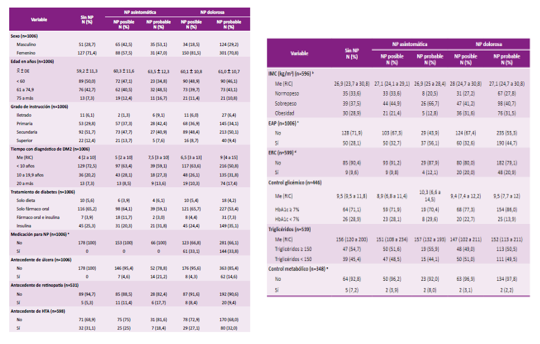
porcentaje, : media, DE: desviación estándar, DM2: diabetes mellitus tipo 2, Me: mediana, RIC: rango intercuartílico, NP: neuropatía periférica, IMC: índice de masa corporal, HTA: hipertensión arterial, EAP: enfermedad arterial periférica, ERC: enfermedad renal crónica, HbA1c: hemoglobina glicosilada, LDL: lipoproteína de baja densidad, PAS: presión arterial sistólica.
a Positiva si hay consumo de carbamazepina, gabapentina, tramadol o similar en los últimos 3 meses.
b Normopeso (IMC < 25 kg/m2), Sobrepeso (IMC 25 a 29,9 kg/m2). Obesidad (IMC: 30 kg/m2 a más)
c EAP positiva si algún pulso está alterado o algún ITB es menor a 0,9.
d ERC sí hay una filtración glomerular calculada por la fórmula CKDEPI menor a 60 mL/min.
e Sí HbA1c: < 7 %, LDL < 100 mg/dl y PAS < 140 mmHg
CONCLUSIONES
Nuestro estudio concluye que el 80% de los pacientes con DM2 que se atienden en el Servicio de Endocrinología del Hospital María Auxiliadora presenta algún síntoma o signo de NP, de los cuales el 60% correspondió a una NP dolorosa y solo 20% fue NP asintomática.
Utilizando una mayor certeza diagnóstica, es decir dos de tres criterios de Toronto, la prevalencia de NP dolorosa es del 42,2% y la NP asintomática del 6,5%. Los fenotipos obtenidos según esta jerarquía presentarían diferentes comportamientos respecto a sexo, tiempo de DM2, antecedente de úlcera, enfermedad arterial periférica y control glicémico. Recomendamos estudios de seguimiento que permitan estimar la efectividad del programa de tamizaje para la prevención de úlcera, así como estimar la utilidad de estos fenotipos para determinar el riesgo de pie diabético.
REFERENCIAS BIBLIOGRÁFICAS
1. Vinik AI, Nevoret M-L, Casellini C, Parson H. Diabetic neuropathy. Endocrinol Metab Clin North Am. 2013, 42(4):747-87. doi: 10.1016/j.ecl.2013.06.001.
2. Pai Y, Lin CH, Lee I, Chang MH. Prevalence and biochemical risk factors of diabetic peripheral neuropathy with or without neuropathic pain in Taiwanese adults with type 2 diabetes mellitus. Diabetes Metab Syndr. 2018;12(2):111-116. doi: 10.1016/j. dsx.2017.09.013.
3. Yovera-Aldana M, Velásquez-Rimachi V, Huerta-Rosario A, More- Yupanqui MD, Osores-Flores M, Espinoza R, et al. Prevalence and incidence of diabetic peripheral neuropathy in Latin America and the Caribbean: A systematic review and meta-analysis. PLoS One. 2021;16(5):e0251642. doi: 10.1371/journal.pone.0251642.
4. Solís-Villanueva J, Michahelles-Barreno C, Rodríguez-Lay G, Farfán- García E, Anticona-Sayán J, Curo-Carrión M. Prevalence and risk factors of diabetic peripheral neuropathy in newly diagnosed patients of diabetes mellitus attending at national hospital. Rev Soc Peru Med Interna. 2019,32(1):6-10.
5. Ibarra T, Rocha J De C, Hernández J. Prevalencia de neuropatía periférica en diabéticos tipo 2 en el primer nivel de atención. Rev Med Chile. 2012;140(9):1126-31. doi: 10.4067/S0034- 98872012000900004.
6. Nascimento OJM do, Pupe CCB, Cavalcanti EBU. Diabetic neuropathy. Rev Dor. 2016;17:46-51. doi: 10.5935/1806-0013.20160047.
7. Themistocleous AC, Ramirez JD, Shillo PR, Lees JG, Selvarajah D, Orengo C, et al. The Pain in Neuropathy Study (PiNS): a cross- sectional observational study determining the somatosensory phenotype of painful and painless diabetic neuropathy. Pain. 2016,157(5):1132-45. doi: 10.1097/j.pain.0000000000000491.
8. Shillo P, Sloan G, Greig M, Hunt L, Selvarajah D, Elliott J, et al. Painful and painless diabetic neuropathies: What is the difference? Curr Diab Rep. 2019,19(6):32. doi: 10.1007/s11892-019-1150-5.
9. Gylfadottir SS, Weeracharoenkul D, Andersen ST, Niruthisard S, Suwanwalaikorn S, Jensen TS. Painful and non-painful diabetic polyneuropathy: Clinical characteristics and diagnostic issues. J Diabetes Investig. 2019,10(5):1148-57. doi: 10.1111/jdi.13105.
10. Tesfaye S, Boulton AJ, Dyck PJ, Freeman R, Horowitz M, Kempler P, et al. Diabetic neuropathies: update on definitions, diagnostic criteria, estimation of severity, and treatments. Diabetes Care. 2010;33(10):2285-93. doi: 10.2337/dc10-1303.
11. Schaper NC, van Netten JJ, Apelqvist J, Bus SA, Hinchliff RJ, Lipsky BA. Guías del IWGDF para la prevención y el manejo de la enfermedad de pie diabético [Internet]. Madrid: IWGDF; 2019 [citado el 2 de enero de 2024]. Disponible en: https://iwgdfguidelines.org/wp- content/uploads/2020/03/IWGDF-Guidelines-2019_Spanish.pdf
12. Escaño-Polanco M, Odriozola F, Davidson A, Pedrosa J, Fuente H, Márquez G. Consenso de expertos para el manejo de la neuropatía diabética. Revista ALAD. 2016;6:121-50.
13. Ziegler D, Hanefeld M, Ruhnau KJ, Meissner HP, Lobisch M, Schütte K, Gries FA. Treatment of symptomatic diabetic peripheral neuropathy with the anti-oxidant alpha-lipoic acid. A 3-week multicentre randomized controlled trial (ALADIN Study). Diabetologia. 1995;38(12):1425-33. doi: 10.1007/BF00400603.
14. Jensen TS, Karlsson P, Gylfadottir SS, Andersen ST, Bennett DL, Tankisi H, et al. Painful and non-painful diabetic neuropathy, diagnostic challenges and implications for future management. Brain. 2021;144(6):1632-1645. doi: 10.1093/brain/awab079.
15. Sun J, Wang Y, Zhang X, Zhu S, He H. Prevalence of peripheral neuropathy in patients with diabetes: A systematic review and meta-analysis. Prim Care Diabetes. 2020,14(5):435-44. Disponible en: doi: 10.1016/j.pcd.2019.12.005.
16. Garoushi S, Johnson MI, Tashani O. Point prevalence of painful diabetic neuropathy in the Middle East and North Africa region: A systematic review with meta-analysis. Libyan J Med Sci. 2018;2(3):85-94. doi: 10.4103/LJMS.LJMS_36_18.
17. Van Hecke O, Austin SK, Khan RA, Smith BH, Torrance N. Neuropathic pain in the general population: a systematic review of epidemiological studies. Pain. 2014,155(4):654-62. doi: 10.1016/j. pain.2013.11.013.
18. Kirthi V, Perumbalath A, Brown E, Nevitt S, Petropoulos IN, Burgess J, et al. Prevalence of peripheral neuropathy in pre- diabetes: a systematic review. BMJ Open Diabetes Res Care. 2021,9(1):e002040. doi: 10.1136/bmjdrc-2020-002040.
19. Fabry V, Gerdelat A, Acket B, Cintas P, Rousseau V, Uro-Coste E, et al. Which method for diagnosing small fiber neuropathy? Front Neurol. 2020;11:342. doi: 10.3389/fneur.2020.00342.
20. Baraz S, Zarea K, Shahbazian HB, Latifi SM. Comparison of the accuracy of monofilament testing at various points of feet in peripheral diabetic neuropathy screening. J Diabetes Metab Disord. 2014;13(1):19. doi: 10.1186/2251-6581-13-19.
21. Dutra LMA, Moura MC, do Prado FA, De Oliveira Lima G, Melo MC, Fernandez RNM, et al. Is it possible to substitute the monofilament test for the Ipswich Touch Test in screening for peripheral diabetic neuropathy? Diabetol Metab Syndr. 2020;12(1):27. doi: 10.1186/ s13098-020-00534-2.
22. Bishop K, Poole R. Common tests for diabetic peripheral neuropathy. Diabetes Practice. 2022;39(6):35-8. doi: 10.1002/pdi.2428.
23. Shehab DK, Al-Jarallah KF, Abraham M, Mojiminiyi OA, Al- Mohamedy H, Abdella NA. Back to basics: ankle reflex in the evaluation of peripheral neuropathy in type 2 diabetes mellitus. QJM. 2012;105(4):315-20. doi: 10.1093/qjmed/hcr212.
24. Selvarajah D, Kar D, Khunti K, Davies MJ, Scott AR, Walker J, et al. Diabetic peripheral neuropathy: advances in diagnosis and strategies for screening and early intervention. Lancet Diabetes Endocrinol. 2019,7(12):938-48. doi: 10.1016/S2213- 8587(19)30081-6.
25. Carmichael J, Fadavi H, Ishibashi F, Shore AC, Tavakoli M. Advances in screening, early diagnosis, and accurate staging of diabetic neuropathy. Front Endocrinol (Lausanne). 2021;12:671257. doi: 10.3389/fendo.2021.6712.
26. Themistocleous AC, Ramirez JD, Serra J, Bennett DL. The clinical approach to small fibre neuropathy and painful channelopathy. Pract Neurol. 2014;14(6):368-79. doi: 10.1136/practneurol-2013-000758.
27. Ziegler D, Nowak H, Kempler P, Vargha P, Low PA. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha- lipoic acid: a meta-analysis. Diabet Med. 2004;21(2):114-21. doi: 10.1111/j.1464-5491.2004.01109.x.
28. Kisozi T, Mutebi E, Kisekka M, Lhatoo S, Sajatovic M, Kaddumukasa M, et al. Prevalence, severity and factors associated with peripheral neuropathy among newly diagnosed diabetic patients attending Mulago hospital: a cross-sectional study. Afr Health Sci. 2017,17(2):463-73. doi: 10.4314/ahs.v17i2.21.
29. Yovera-Aldana M, Pérez-Cavero S, Pinedo-Torres I, Zubiate-López C. Prevalence of foot at-risk and its associated characteristics among outpatients with diabetes mellitus in a Peruvian public hospital. Rev Diabet Stud. 2022;18(1):1-9. doi: 10.1900/RDS.2022.18.1.
30. Iacopi E, Pieruzzi L, Riitano N, Abbruzzese L, Goretti C, PiaggesiA. The Weakness of the Strong Sex: Differences Between Menand Women Affected by Diabetic Foot Disease. Int J Low ExtremWounds. 2023;22(1):19-26. doi: 10.1177/1534734620984604.
31. Zoungas S, Woodward M, Li Q, Cooper ME, Hamet P, Harrap S, et al. Impact of age, age at diagnosis and duration of diabetes on the risk of macrovascular and microvascular complications and death in type 2 diabetes. Diabetologia. 2014;57(12):2465-74. doi: 10.1007/ s00125-014-3369-7.
32. Kitila KM, Hajure M. Why too soon? Predictors of time to diabetic peripheral neuropathy among newly diagnosed diabetes mellitus patients: a multicenter follow-up study at health-care setting of Ethiopia. Arch Public Health. 2023;81(1):186. doi: 10.1186/s13690- 023-01202-3.
33. Jasso-Huamán LE, Villena-Pacheco A, Guevara-Linares X. Control metabólico en pacientes diabéticos ambulatorios de un hospital general. Rev Med Hered. 2015;26(3):167-172.
34. Hwang YT, Davies G. “Insulin neuritis” to “treatment-induced neuropathy of diabetes”: new name, same mystery. Pract Neurol. 2016;16(1):53-5. doi: 10.1136/practneurol-2015-001215.
35. Dirección General de Medicamentos, Insumos y Drogas, Ministerio de Salud del Perú. Petitorio nacional único de medicamentos esenciales: Perú 2010 [Internet]. Lima: Minsa; 2010. Disponible en: https://www.gob.pe/institucion/minsa/informes- publicaciones/321918-petitorio-nacional-unico-de-medicamentos- esenciales-peru-2010
36. Morriss WW, Roques CJ. Pain management in low- and middle- income countries. BJA Educ. 2018;18(9):265-270. doi: 10.1016/j. bjae.2018.05.006.
37. Karam SL, Dendy J, Polu S, Blonde L. Overview of Therapeutic Inertia in Diabetes: Prevalence, Causes, and Consequences. Diabetes Spectr. 2020;33(1):8-15. doi: 10.2337/ds19-0029.
38. Bommer C, Sagalova V, Heesemann E, Manne-Goehler J, Atun R, Bärnighausen T, et al. Global economic burden of diabetes in adults: Projections from 2015 to 2030. Diabetes Care. 2018,41(5):963-70. doi: 10.2337/dc17-1962.
39. Bommer C, Sagalova V, Heesemann E, Manne-Goehler J, Atun R, Bärnighausen T, et al. Global Economic Burden of Diabetes in Adults: Projections From 2015 to 2030. Diabetes Care. 2018;41(5):963-970. doi: 10.2337/dc17-1962.
40. Maldonado-Valer T, Pareja-Mujica LF, Corcuera-Ciudad R, Terry- Escalante FA, Chevarría-Arriaga MJ, Vasquez-Hassinger T, et al. Prevalence of diabetic foot at risk of ulcer development and its components stratification according to the international working group on the diabetic foot (IWGDF): A systematic review with metanalysis. PLoS One. 2023,18(11):e0284054. doi: 10.1371/ journal.pone.0284054.
Notas de autor
myovera@cientifica.edu.pe