Originales Breves
Embolización de aneurismas intracraneales múltiples en sesión única
Multiple intracranial aneurysm embolization in a single session
Embolización de aneurismas intracraneales múltiples en sesión única
Acta Médica Peruana, vol. 40, núm. 2, pp. 120-127, 2023
Colegio Médico del Perú

Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Recepción: 26 Marzo 2023
Aprobación: 12 Julio 2023
Resumen: Objetivo: Determinar los resultados clínicos y angiográficos en pacientes con aneurismas intracraneales múltiples tratados endovascularmente en una única sesión. Materiales y Métodos: Se incluyó a todos los pacientes mayores de 18 años con aneurismas múltiples (≥2), rotos o no rotos, tratados con terapia endovascular en una única sesión entre 2019 y 2021. Se recolectaron los datos clínicos y angiográficos. Se determinó la tasa de oclusión inmediata y del seguimiento. La escala de Rankin modificado se usó para valorar el resultado clínico. Resultados: Se trataron 25 pacientes, de los cuales 14 se presentaron con hemorragia subaracnoidea. Se diagnosticaron un total de 78 aneurismas, de los cuales 59 aneurismas fueron tratados. La localización más frecuente fue el segmento oftálmico. La altura máxima promedio fue de 5.2mm, lo cual tuvo diferencia estadística significativa con el estado de ruptura (p ≤ 0.02). El principal tipo de tratamiento endovascular fue la técnica de remodeling en el 39 % de casos. El Raymond Roy inmediato fue I en el 60 % y IIIa en el 35 % de casos. La tasa de complicaciones fue del 24 % y de mortalidad fue del 8 %. Conclusiones: El tratamiento endovascular en una única sesión es una opción efectiva y segura en casos de aneurismas intracraneales múltiples en nuestra institución con tasa de oclusión y complicaciones aceptable.
Palabras clave: Aneurisma Intracraneal, Procedimientos Endovasculares, Stents, Embolización Terapéutica, Hemorragia Subaracnoidea.
Abstract: Objective: To determine clinical and angiographical outcomes in patients with multiple intracranial aneurysms who underwent endovascular therapy in a single session. Materials and Methods: Patients older than 18 years with multiple (≥2) ruptured or non-ruptured aneurysms were included, and all of them underwent endovascular therapy in a single session between 2019 and 2021. Clinical and angiographic data was collected. Immediate occlusion and follow-up data were collected. Rankin modified scale was used for assessing clinical outcomes. Results: Twenty-five patients were treated, and fourteen had subarachnoid hemorrhage. Seventy-eight aneurysms were diagnosed, and 59 of them were treated. The most frequent location was at the ophthalmic segment. Maximum average height was 5.2- mm, which showed significant statistical difference with a ruptured condition (p≤0.02). The main modality for endovascular therapy was the remodeling technique, which was used in 39% of all cases. Immediate Raymond Roy staging was I in 60% of all cases, and IIIa in 35% of all cases. Complication rate was 24%, and mortality rate was 8%. Conclusions: Single session endovascular therapy is an effective and safe option for cases of multiple intracranial aneurysms in our institution. Occlusion and complication rates were acceptable.
Keywords: Intracranial Aneurysm, Endovascular Procedures, Stents, Embolization, Therapeutic, Subarachnoid Hemorrhage.
INTRODUCCIÓN
Los aneurismas intracraneales múltiples se diagnostican en mayor medida, debido al mayor uso de diferentes herramientas de imagen no invasivas. Su incidencia oscila entre el 7 y el 45% [1–4]. Entre las estrategias para tratar los aneurismas múltiples se encuentran el seguimiento clínico, el tratamiento endovascular (TEV), la microcirugía y una combinación de ambos.
La TEV tiene algunas ventajas sobre otras terapias: tratar en una única sesión múltiples aneurismas, rotos y no rotos, donde la identificación del estado de ruptura en algunos casos es difícil. Otro beneficio es la eliminación del riesgo de sangrado de aneurismas no rotos en el futuro. Además, la TEV permite tratar múltiples aneurismas en una única sesión mediante un único abordaje, sin microlesiones acumulativas por retracción cerebral o manipulación arterial [5–9]. También, hay que tener en cuenta que la oclusión de aneurismas intracraneales por TEV se considera una técnica segura [10–13]. Asimismo, la TEV tiene la ventaja de tener una estancia hospitalaria más corta y ser mínimamente invasiva en comparación con el tratamiento microquirúrgico [1].
No se sabe cuál es la mejor opción para el manejo de aneurismas múltiples. Cuando hay un aneurisma bilateral y se realiza un abordaje microquirúrgico, se requiere una doble craneotomía, aumentando el tiempo operatorio y acumulando microlesión por retracción cerebral o manipulación arterial [5]. Presentamos una serie de 25 pacientes y analizamos las características clínicas y angiográficas de pacientes con aneurismas múltiples tratados endovascularmente en una única sesión.
MATERIALES Y MÉTODOS
Selección de Pacientes
La población de estudio incluyó a todos los pacientes mayores de 18 años que presentaron el diagnóstico de aneurisma intracraneal roto y no roto en nuestra institución entre enero de 2019 y diciembre de 2021, que fueron sometidos a terapia endovascular de dos o más aneurismas en una única sesión. Se excluyeron los pacientes con aneurismas intracraneales rotos o no rotos que se sometieron a manejo conservador o tratamiento microquirúrgico, o que tenían un solo aneurisma tratado con terapia endovascular. La recolección de datos se realizó utilizando la base de datos del Servicio de Neurocirugía Endovascular de la institución. Los pacientes fueron seleccionados según el diagnóstico de “aneurisma intracraneal”, “hemorragia subaracnoidea” o por su CIE-10 “I67.1”, “I60.0”, “I60.1”, “I60.2”, “I60 .3”, “I60.4”, “I60.6”, “I60.7”, “I60.8” y “I60.9”.
Variables y Análisis de Datos
Las variables clínicas incluyeron edad, sexo, antecedentes médicos, escala de Rankin modificada (mRS) al ingreso, mRS al alta, escala de coma de Glasgow (ECG) al ingreso, ECG al alta, escala de Hunt Hess, tiempo desde la admisión hasta el tratamiento, tiempo desde la ruptura del aneurisma hasta el tratamiento, estancia hospitalaria y seguimiento.
Las variables relacionadas con el aneurisma incluyeron número de aneurismas por paciente, estado de ruptura, ubicación del aneurisma, lado, tamaño, altura máxima del domo, diámetro del cuello, relación de proyección (PR), número de coils utilizados por aneurisma, escala de Fisher, tipo de tratamiento, tipo de stent, tipo de balón, clasificación de oclusión de Raymond-Roy (RROC) en el posoperatorio inmediato, RROC en el seguimiento [14], escala de clasificación de O´Kelly Marotta (OKM) en el posoperatorio inmediato, OKM en el seguimiento, complicaciones intraoperatorias (ruptura de aneurisma, eventos tromboembólicos) y complicaciones posoperatorias (isquemia cerebral tardía, sepsis) [15]. Un mRS de 0 a 2 se consideró un buen resultado clínico, mientras que un mRS de 3 a 6 se consideró un mal resultado clínico [16].
Para los aneurismas de los segmentos oftálmico y clinoideo se empleó la clasificación de Barami [17,18]. El índice de proyección (PR) se calculó dividiendo la altura máxima del aneurisma entre el diámetro del cuello [19]. Para el tipo de aneurisma según el tamaño, se utilizó la clasificación de “The Natural Course of Unruptured Cerebral Aneurysms in a Japanese Cohort (UCAS) study” [20]. En pacientes que presentaron hemorragia subaracnoidea por ruptura de aneurisma intracraneal, se utilizaron las escalas de Hunt Hess y Fisher [21].
Las variables categóricas se expresaron como porcentajes y las numéricas como medias. Para el análisis estadístico se utilizaron las pruebas t de student y chi-cuadrado, con una p < 0,05 para demostrar que la diferencia era estadísticamente significativa.
Protocolo del Tratamiento Endovascular
En todos los pacientes se mantuvo durante todo el procedimiento una infusión continua de suero salino con 1500UI de heparina sódica por litro de solución, con un goteo suficiente para mantener permeables los catéteres guía y los microcatéteres. Cuando se utilizó la técnica de remodeling se emplearon los microcatéteres balón Scepter C®, Eclipse®, Eclipse 2L® o Hyperform®, según preferencia del médico tratante. Cuando se utilizó coils, se emplearon coils Optima®, Microplex®, Hydroframe®, Axium® o Tjwy®. En los pacientes a los que se les colocó un stent convencional (LVIS®, LVIS Jr®, Leo®, Leo Baby®), se administró terapia antiplaquetaria doble (TAPD) 30 minutos antes de la colocación del stent con 300mg de clopidogrel y 300mg de aspirina. Los pacientes a los que se les colocó un diversor de flujo (FRED®, Silk®, Phenox®) estaban bajo TAPD con 75mg de clopidogrel y 100mg de aspirina 7 días antes del procedimiento. En algunos pacientes se utilizó ticagrelor en lugar de clopidogrel. Se administró un bolo intravenoso de heparina sódica a dosis de 50UI/kg justo en el momento de iniciar el despliegue del stent, seguido de un bolo intravenoso de 1000UI por cada hora adicional.
RESULTADOS
Características Generales de los Pacientes
Veinticinco pacientes con aneurismas múltiples intracraneales rotos y no rotos fueron tratados con terapia endovascular en una única sesión. Catorce pacientes presentaron hemorragia subaracnoidea. La edad media fue de 53,2 años, las mujeres representaron el 88 % de los casos y el 44 % presentó hipertensión arterial. El promedio de aneurismas fue de 3,1/ paciente, con una media de 2,4 aneurismas tratados por paciente. La mayoría de los pacientes con aneurisma roto presentaban un mRS de 2 (71,4 %). Las características clínicas de los pacientes se resumen en la Tabla 1.
Características Angiográficas de los Aneurismas
Se diagnosticaron un total de 78 aneurismas intracraneales, de los cuales se trataron 59 (75,7 %). El 59 % de los aneurismas se localizaron en el lado derecho y el 21 % se rompieron. El segmento oftálmico de la arteria carótida interna (ACI) fue la localización principal en el 41 % de los casos, seguido del segmento comunicante posterior en el 37 %. Para los aneurismas del segmento oftálmico, Barami tipo IIIa fue la localización más frecuente en el 31 % de los casos. La altura máxima del domo promedio de los aneurismas fue de 5,2 mm, mientras que el diámetro promedio del cuello fue de 2,9 mm. La altura máxima del domo promedio en aneurismas rotos fue de 7,2 mm y en aneurismas no rotos de 4,7 mm, lo que resultó estadísticamente significativo (p < 0,02). El PR de aneurismas rotos fue de 2,96, mientras que en aneurismas no rotos fue de 1,67, que fue estadísticamente significativo (p < 0,025). Las características angiográficas se resumen en la Tabla 2.
| n = 25 pacientes | p | |
| Mujer | 22 (88%) | |
| Edad promedio | 53.2 | |
| ECG promedio | 14 | |
| mRS promedio | 2 | |
| Hipertensión | 11 (44%) | 0.29 |
| Hemorragia Subaracnoidea | 14 (56%) | |
| Escala de Hunt-Hess | ||
| HH II | 11 (79%) | |
| HH III | 1 (7%) | |
| HH IV | 2 (14%) | |
| Escala de Fisher | ||
| Grado III | 5 (36%) | |
| Grado IV | 9 (65%) | |
| Tiempo promedio desde la admisión hasta el tratamiento | 2.6 días | 0.45 |
| Con Hemorragia Subaracnoidea | 2.6 días | |
| Sin Hemorragia Subaracnoidea | 2.7 días | |
| Tiempo promedio desde la ruptura del aneurisma hasta el tratamiento | 40 días | |
| Estancia hospitalaria | 12.1 días | < 0.005 |
| Con Hemorragia Subaracnoidea | 17 días | |
| Sin Hemorragia Subaracnoidea | 5.8 días | |
| Tiempo promedio de seguimiento | 11 meses | |
| Porcentaje de seguimiento | 37% | |
Consideraciones Técnicas y Resultados Angiográficos
La técnica endovascular empleada con mayor frecuencia fue la de remodeling en un 39 % de los casos, seguida del diversor de flujo en un 25 %. El número promedio de coils utilizados fue de 1,9/aneurisma. Para el coiling, se logró un grado I de RROC en el posoperatorio inmediato en 24 casos (60 %). No se encontró significancia estadística entre el estado de ruptura y el resultado angiográfico inmediato (p = 0,10). Se realizó seguimiento en 18 aneurismas (45 %) tratados mediante coiling: 12 casos (67 %) presentaron RROC grado I y 5 casos (28 %) RROC grado II (Tabla 3). Para el diversor de flujo, se logró un grado D de OKM en el posoperatorio inmediato en 7 casos (33 %). Todos los aneurismas tratados con diversor de flujo fueron no rotos. Solo 2 aneurismas (13 %) fueron seguidos, con grado D en el 100 % de los casos. En total, se realizó un seguimiento del 37 % de los aneurismas, con una media de 11 meses (Tabla 4).
| N = 78 aneurisma | p | |
| Rotos | 16 (21%) | |
| No Rotos | 62 (79%) | |
| Promedio de aneurismas por paciente | 3.1 aneurismas/ paciente | |
| Aneurismas tratados | n = 58 aneurismas | |
| Rotos | 16 (27%) | |
| No Rotos | 43 (73%) | |
| Promedio de aneurismas tratados por paciente | 2.4 aneurismas/ paciente | |
| Lado Derecho | 46 (59%) | |
| Localización | ||
| Segmento Oftálmico | 32 (41%) | |
| Barami Ia | 6 (19%) | |
| Barami Ib | 6 (19%) | |
| Barami II | 9 (28%) | |
| Barami IIIa | 10 (31%) | |
| Barami IIIb | 1 (3%) | |
| Segmento Comunicante | 29 (37%) | |
| Arteria Comunicante Posterior | 23 (79%) | |
| Arteria Coroidea Anterior | 6 (21%) | |
| Arteria Cerebral Media | 10 (13%) | |
| Arteria Comunicante Anterior | 3 (4%) | |
| Bifurcación Carotídea | 3 (4%) | |
| Arteria Cerebral Anterior | 1 (1%) | |
| Tamaño (mm) | ||
| Muy Pequeños | 30 (38%) | |
| Pequeños | 17 (22%) | |
| Medianos | 27 (35%) | |
| Grandes | 3 (4%) | |
| Gigantes | 1 (1%) | |
| Altura máxima del domo del aneurisma (mm) | 5.2 mm | < 0.02 |
| No Rotos | 4.6 mm | |
| Rotos | 7.2 mm | |
| Diámetro del Cuello (mm) | 2.9 mm | < 0.4 |
| No Rotos | 2.9 mm | |
| Rotos | 3 mm | |
| Razón de Proyección (PR) | 1.84 | < 0.02 |
| No Rotos | 1.67 | |
| Rotos | 2.96 | |
| Tipo de tratamiento | |
| Coils + balón (Remodeling) | 23 (40%) |
| No Roto Roto | 16 7 |
| Diversor de Flujo | 15 (25%) |
| No Roto Roto | 15 0 |
| Coils | 8 (14%) |
| No Roto Roto | 4 4 |
| Coils + stent | 6 (10%) |
| No Roto Roto | 3 3 |
| Sólo Stent | 4 (7%) |
| No Roto Roto | 4 0 |
| Stent + balón + coils | 3 (5%) |
| No roto Roto | 1 2 |
| Número de coils usados Tipo de diversor de flujo | 1.9 coils/aneurisma |
| FRED® Phenox® Silk® | 9 (60%) 4 (27%) 2 (13%) |
| Tipo de stent | |
| LVIS® | 8 (62%) |
| LVIS Jr® | 3 (23%) |
| Leo® | 1 (7%) |
| Leo Baby® | 1 (7%) |
| Tipo de balón | |
| Scepter C® | 14 (54%) |
| Eclipse 2L® | 8 (31%) |
| Eclipse® | 3 (12%) |
| Hyperform® | 1 (3%) |
Seguimiento Clínico y Angiográfico
Al alta, el 80 % de los pacientes presentaban una ECG de 15 puntos. El 100 % de los pacientes con aneurismas no rotos presentaron ECG de 15 puntos, mientras que el 64 % de los pacientes con aneurismas rotos presentaron ECG de 15 puntos (p= 0,013). Al alta, la media de mRS fue de 2. El 91 % de los pacientes con aneurismas no rotos presentaron mRS 1, mientras que el 29 % de los pacientes con aneurismas rotos presentaron mRS 1. En general, el 76 % de los casos mostró un buen resultado clínico (mRS 0 – 2), de los cuales el 57 % fueron aneurismas rotos. Se encontró significancia estadística entre el estado de ruptura y la buena evolución clínica al alta (p = 0,006). El seguimiento clínico y angiográfico se resume en la Tabla 5.
Se presentaron complicaciones en 6/25 pacientes (24 %), todas ellas en casos de hemorragia subaracnoidea (43 %; p = 0,006). Cuatro pacientes presentaron isquemia cerebral tardía, un paciente una disección de la arteria carótida interna tratada con stent y un paciente desarrolló un shock séptico por neumonía nosocomial. La tasa de mortalidad fue del 8 % (2 casos), todos en casos de hemorragia subaracnoidea (14 %), que no tuvo significancia estadística (p = 0,10).
El tiempo promedio entre el ingreso y el tratamiento fue de 2,6 días, similar entre pacientes con aneurismas rotos (2,6 días) y no rotos (2,7 días). La estancia hospitalaria promedio fue de 12,1 días, mayor en pacientes con aneurisma roto (17 días), en comparación con aneurisma no roto (5,8 días) (p < 0,005).
DISCUSIÓN
En nuestro estudio el objetivo fue determinar los resultados clínicos y angiográficos después de la embolización de aneurismas múltiples en una única sesión. Encontramos aceptables tasas de oclusión en el seguimiento angiográfico inmediato y a mediano plazo, corta estancia hospitalaria y aceptables tasas de morbimortalidad, a pesar del bajo número de pacientes analizados.
| OKM | Inmediato | Seguimiento |
| A | 3 | 0 |
| B | 7 | 0 |
| C | 0 | 0 |
| D | 5 | 2 |
| No Roto | Roto | p | |
| Escala de Rankin Modificada | 0.006 | ||
| mRS 0 – 2 | |||
| En la admisión | 11 | 11 | |
| Al alta | 11 | 8 | |
| mRS 3 – 6 | |||
| En la admisión | 0 | 3 | |
| Al alta | 0 | 6 | |
| RROC inmediato | 0.10 | ||
| I | 14 | 10 | |
| II | 0 | 0 | |
| IIIa | 8 | 6 | |
| IIIb | 2 | 0 | |
| RROC en el seguimiento (18 casos) | |||
| I | 6 | 6 | |
| II | 5 | 0 | |
| IIIa | 0 | 0 | |
| IIIb | 0 | 1 | |
Los aneurismas intracraneales son la causa más importante de hemorragia subaracnoidea espontánea, con una morbilidad del 8-20 % y una mortalidad del 37-57 % [22]. Su incidencia varía según los estudios entre el 7 y el 45 % [1]. Rocca et al en un estudio de 19 años encontraron que la incidencia de aneurismas múltiples fue del 16,1 % [23]. Vargas et al en un estudio de 8 años sobre aneurismas tratados quirúrgicamente encontraron que la incidencia de aneurismas múltiples fue del 18,3 % [24,25]. El riesgo de ruptura es mayor en pacientes con aneurismas múltiples en comparación con pacientes con un solo aneurisma. Además, el pronóstico de estos pacientes es peor en comparación con los pacientes con un solo aneurisma. Por ello, el tratamiento preventivo es mucho más razonable en estos pacientes [5,26]. Jeon et al afirmaron que la embolización con coils en una única sesión parece ser un tratamiento eficaz y seguro con baja morbilidad y mortalidad [22]. Asimismo, la terapia endovascular tiene la ventaja de tener una estancia hospitalaria más corta y ser mínimamente invasiva en comparación con el tratamiento microquirúrgico [1].
El diversor de flujo está cambiando rápidamente las opciones de tratamiento endovascular de los aneurismas intracraneales. Su papel en el tratamiento de aneurismas múltiples en tándem no está bien estudiado. John et al encontraron que los diversores de flujo parecen ser seguros, factibles y efectivos para tratar aneurismas múltiples. Además, el diversor de flujo tiene la ventaja de reconstruir el segmento displásico de la arteria sin embolización adicional. Asimismo, el diversor de flujo presenta una alta tasa de oclusión, baja tasa de recanalización y retratamiento [27,28]. Es por esto que el 25% de los aneurismas tratados en el presente estudio fueron manejados con un diversor de flujo. Todos ellos fueron aneurismas no rotos, debido a la contraindicación relativa de doble antiagregación en un paciente con aneurisma roto en agudo.
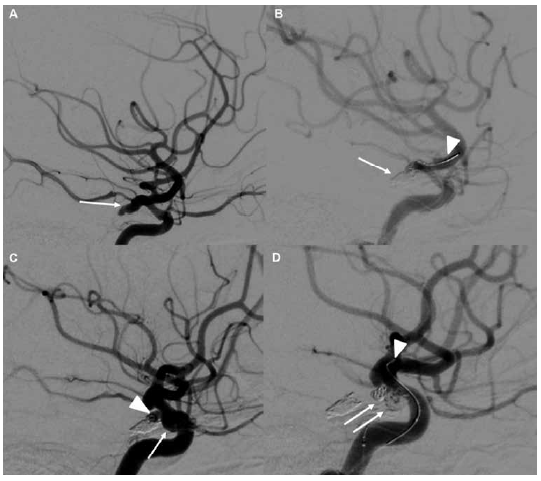
Figura 1
Caso Ilustrativo. Mujer de 38 años ingresa con cefalea súbita y vómitos la angiotomografía muestra una hemorragia subaracnoidea y 3 aneurismas comunicante posterior izquierdo roto y 2 aneurismas no rotos en el segmento oftálmico de la arteria carótida derecho Se usó la técnica de remodeling en los 3 aneurismas (A) Angiografía de arteria carótida interna ACI izquierda en vista lateral muestra un aneurisma de arteria comunicante posterior roto flecha (B) Vista lateral de la ACI izquierda muestra una adecuada obliteración con coils del aneurisma flecha además se evidencia la parte distal del microcatéter balón y la microguía cabeza de flecha (C) ACI derecha en vista lateral que muestra 2 aneurismas no rotos en el segmento oftálmico cabeza de flecha y flecha (D) ACI derecha en vista lateral que muestra la adecuada obliteración de ambos aneurismas flechas además se logra evidenciar la parte distal del microcatéter balón y la microguía cabeza de flecha
El segundo ISUIA (International Study on Unruptured Intracranial Aneurysms) y el UCAS (Unruptured Cerebral Aneurysms in Japanese Cohort) difieren en la definición del tamaño del aneurisma, que estratifica el riesgo de ruptura. El primer ISUIA definió aneurismas pequeños como aquellos menores de 10 mm, mientras que los finlandeses y japoneses todavía tienen un riesgo significativo de ruptura con aneurismas pequeños (menores de 5 mm) [20]. Pues bien, el tipo de aneurisma según tamaño más frecuente en nuestro estudio fueron los muy pequeños con un 38 %, seguidos de los medianos con un 35 % y luego los pequeños con un 22 %.
El PR no ha sido ampliamente estudiado en términos de relación con el estado de ruptura, pero Tanioka et al encontraron que el PR promedio de los aneurismas rotos fue de 1,23 mientras que en el grupo de aneurismas no rotos fue de 0,76, lo que tuvo una diferencia estadísticamente significativa (p < 0,001) [19,29]. En nuestro estudio el PR promedio en los aneurismas rotos fue de 2,96 y en los aneurismas no rotos fue de 1,67, lo cual tuvo diferencia estadísticamente significativa (p < 0,02), corroborando lo encontrado por Tanioka et al.
Oh et al encontraron en su estudio de 28 pacientes con aneurismas múltiples que la RROC inmediata era I en el 81,7 %, II en el 10 % y III en el 8,3 %, con una tasa de complicaciones del 3,3 % [5], mientras que Cho et al encontraron oclusión completa en el 90,8 % de los pacientes con tasa de recanalización del 6,3 % [30]. Shen et al encontraron que el seguimiento angiográfico se logró en el 86,1 %, mostrando oclusión completa en el 97,9 %, mientras que el 2,1 % presentó recanalización, con una tasa de complicaciones del 8,3 % [10]. Jeon et al encontraron un resultado favorable (mRS 0-2) en el 97,7 % de sus pacientes sin hemorragia subaracnoidea y en el 77,1 % de sus pacientes con hemorragia subaracnoidea [22]. Dong et al encontraron oclusión completa en el 90,8 % del grupo microquirúrgico y en el 65 % del grupo endovascular, pero si se sumaba la oclusión completa y casi completa, alcanzaban el 96,7 % en el grupo endovascular [1].
Varios trabajos reportaron resultados similares en cuanto al resultado clínico y angiográfico, dado que nuestros resultados angiográficos inmediatos alcanzados fueron RROC I en 60 % y RROC IIIa en 35 % de los casos. A pesar de que tuvimos un seguimiento del 37 %, más del 90 % de los casos lograron una oclusión completa o casi completa (RROC I y RROC II). Además, el 76 % de los pacientes tratados presentaron una buena evolución, especialmente en los aneurismas no rotos y el 57 % en los aneurismas rotos.
Nuestro estudio tiene varias limitaciones: el diseño retrospectivo y el pequeño número de casos no permitieron establecer asociaciones estadísticas. El número de casos para seguimiento clínico y angiográfico fue pequeño. Son pocos los centros en nuestro país que cuentan con la tecnología para realizar procedimientos endovasculares, por lo que los resultados aquí obtenidos deben tomarse con cautela por el sesgo de selección. Se concluye que la terapia endovascular en una única sesión para el manejo de aneurismas múltiples intracraneales es eficaz y segura, con menor estancia hospitalaria y aceptables resultados en el seguimiento clínico y angiográfico a mediano plazo.
REFERENCIAS BIBLIOGRÁFICAS
1. Dong QL, Gao BL, Cheng ZR, et al. Comparison of surgical and endovascular approaches in the management of multiple intracranial aneurysms. Int J Surg. 2016;32:129-135. doi:10.1016/j. ijsu.2016.07.004.
2. Ellamushi HE, Grieve JP, Jäger HR, Kitchen ND. Risk factors for the formation of multiple intracranial aneurysms. J Neurosurg. 2001;94(5):728-732. doi:10.3171/jns.2001.94.5.0728.
3. Sfyroeras GS, Dalainas I, Giannakopoulos TG, Antonopoulos K, Kakisis JD, Liapis CD. Flow-diverting stents for the treatment of arterial aneurysms. J Vasc Surg. 2012;56(3):839-846. doi:10.1016/j. jvs.2012.04.020.
4. Nehls DG, Flom RA, Carter LP, Spetzler RF. Multiple intracranial aneurysms: determining the site of rupture. J Neurosurg. 1985;63(3):342-348. doi:10.3171/jns.1985.63.3.0342.
5. Oh K, Lim YC. Single-session Coil Embolization of Multiple Intracranial Aneurysms. J Cerebrovasc Endovasc Neurosurg. 2013;15(3):184. doi:10.7461/jcen.2013.15.3.184.
6. Chung J, Shin YS. Multiple intracranial aneurysms treated by multiple treatment modalities. Neurosurgery. 2011;69(4):E1030-1032. doi:10.1227/NEU.0b013e31822a5280.
7. Clatterbuck RE, Tamargo RJ. Contralateral Approaches to Multiple Cerebral Aneurysms. OperNeurosurg. 2005;57(suppl_1):160-163. doi:10.1227/01.NEU.0000163601.37465.6E.
8. Lu HT, Tan HQ, Gu BX, Wu-Wang, Li MH. Risk factors for multiple intracranial aneurysms rupture: A retrospective study. Clin Neurol Neurosurg. 2013;115(6):690-694. doi:10.1016/j. clineuro.2012.08.011.
9. Rinne J, Hernesniemi J, Niskanen M, Vapalahti M. Management Outcome for Multiple Intracranial Aneurysms: 31. Neurosurgery. 1995;36(1):31-38. doi:10.1227/00006123-199501000-00003.
10. Shen X, Xu T, Ding X, Wang W, Liu Z, Qin H. Multiple intracranial aneurysms: endovascular treatment and complications. IntervNeuroradiol J Peritherapeutic Neuroradiol Surg Proced Relat Neurosci. 2014;20(4):442-447. doi:10.15274/INR-2014-10037.
11. Heiskanen O, Marttila I. Risk of Rupture of a Second Aneurysm in Patients With Multiple Aneurysms. J Neurosurg. 1970;32(3):295- 299. doi:10.3171/jns.1970.32.3.0295.
12. Xavier AR, Rayes M, Pandey P, Tiwari A, Kansara A, Guthikonda M. The safety and efficacy of coiling multiple aneurysms in the same session. J NeuroInterventional Surg. 2012;4(1):27-30. doi:10.1136/ jnis.2009.001974.
13. Lv X, Li Y, Liu A, Wu Z. Endovascular Management of Multiple Cerebral Aneurysms in Acute Subarachnoid Hemorrhage Associated with Fenestrated Basilar Artery: A Case Report and Literature Review. Neuroradiol J. 2008;21(1):137-142. doi:10.1177/197140090802100120.
14. Mendenhall SK, Sahlein DH, Wilson CD, et al. The Natural History of Coiled Cerebral Aneurysms Stratified by Modified Raymond-Roy Occlusion Classification. World Neurosurg. 2019;128:e417-e426. doi:10.1016/j.wneu.2019.04.167.
15. Rodríguez García PL, Rodríguez Pupo LR, Rodríguez García D. Diagnóstico de la isquemia cerebral tardía y el vasospasmo cerebral en la hemorragia subaracnoidea. Neurología. 2010;25(5):322-330. doi:10.1016/j.nrl.2009.12.006.
16. Nobels-Janssen E, Postma EN, Abma IL, et al. Inter-method reliability of the modified Rankin Scale in patients with subarachnoid hemorrhage. J Neurol. 2022;269(5):2734-2742. doi:10.1007/ s00415-021-10880-4.
17. Baz RA, Scheau C, Niscoveanu C, Bordei P. Morphometry of the Entire Internal Carotid Artery on CT Angiography. Medicina (Mex). 2021;57(8):832. doi:10.3390/medicina57080832.
18. Yi ZQ, Li L, Liu Z, et al. [Microsurgical treatment of paraclinoid aneurysms]. ZhonghuaYi Xue Za Zhi. 2019;99(4):266-271. doi:10.3760/cma.j.issn.0376-2491.2019.04.006.
19. Tanioka S, Ishida F, Yamamoto A, et al. Machine Learning Classification of Cerebral Aneurysm Rupture Status with Morphologic Variables and Hemodynamic Parameters. RadiolArtif Intell. 2020;2(2):e190077. doi: 10.1148/ryai.2019190077.
20. Merritt W, Berns H, Ducruet A, Becker T. Definitions of intracranial aneurysm size and morphology: A call for standardization. Surg Neurol Int. 2021;Oct 6:506.
21. Kapapa T, Tjahjadi M, König R, Wirtz CR, Woischneck D. Which Clinical Variable Influences Health-Related Quality of Life the Most After Spontaneous Subarachnoid Hemorrhage? Hunt and Hess Scale, Fisher Score, World Federation of Neurosurgeons Score, Brussels Coma Score, and Glasgow Coma Score Compared. World Neurosurg. 2013;80(6):853-858. doi:https://doi.org/10.1016/j. wneu.2012.08.021.
22. Jeon P, Kim BM, Kim DJ, Kim DI, Suh SH. Treatment of Multiple Intracranial Aneurysms with 1-Stage Coiling. Am J Neuroradiol. 2014;35(6):1170 LP - 1173. doi:10.3174/ajnr.A3821.
23. Rocca U, Rossell A, Dávila A, Bromley L, Palacios F. Aneurismas cerebrales. Rev Neuropsiquiatría. 2011;64:384-406. https:// revistas.upch.edu.pe/index.php/RNP/article/view/1500/1528.
24. Vargas JF, Palacios F, Tumi A, et al. Perfil epidemiológico, clínico y de laboratorio de los pacientes sometidos a tratamiento microquirúrgico por aneurismas múltiples en el Hospital Guillermo Almenara del 2010 al 2017. Peru J Neurosurg. 2019;1(2):31-35.
25. Vargas J, Rodríguez R, Durand W, et al. Aneurismas rotos múltiples complejos tratados con embolización en una sesión única: reporte de caso. PeruJ Neurosurg. 2021;3(1):23-30.
26. Kaminogo M, Yonekura M, Shibata S. Incidence and Outcome of Multiple Intracranial Aneurysms in a Defined Population. Stroke. 2003;34(1):16-21. doi:10.1161/01.STR.0000046763.48330.AD.
27. John S, Bain M, Cerejo R, et al. Flow Diverter Treatment of Tandem Intracranial Aneurysms. World Neurosurg. 2017;107:142-147. doi:https://doi.org/10.1016/j.wneu.2017.07.146.
28. O’Kelly CJ, Krings T, Fiorella D, Marotta TR. A Novel Grading Scale for the Angiographic Assessment of Intracranial Aneurysms Treated Using Flow Diverting Stents. Interv Neuroradiol. 2010;16(2):133- 137. doi:10.1177/159101991001600204.
29. Ujiie H, Tamano Y, Sasaki K, Hori T. Is the aspect ratio a reliable index for predicting the rupture of a saccular aneurysm? Neurosurgery. 2011;48(3):495-502.
30. Cho YD, Ahn JH, Jung SC, et al. Single-Stage Coil Embolization of Multiple Intracranial Aneurysms: Technical Feasibility and Clinical Outcomes. Clin Neuroradiol. 2016;26(3):285-290. doi:10.1007/ s00062-014-0367-6.