Reportes de Casos
Viruela del mono (MPOX) en paciente varón heterosexual VIH negativo
Monkeypox (MPOX) in an HIV negative heterosexual male patient
Viruela del mono (MPOX) en paciente varón heterosexual VIH negativo
Acta Médica Peruana, vol. 39, núm. 4, pp. 381-385, 2022
Colegio Médico del Perú

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
Recepción: 08 Diciembre 2022
Aprobación: 20 Enero 2023
Resumen: Se presenta el caso de un paciente varón de 28 años, heterosexual, con VIH negativo que desarrolló erupción cutánea intensa caracterizada por la presencia de vesículas, pústulas y pápulas umbilicadas confluentes en el pene y región púbica con escasa diseminación en el resto del cuerpo, sin adenopatía ni manifestaciones sistémicas, cuatro días después de haber tenido relaciones sexuales con una prostituta aparentemente sana. El hisopado de las lesiones dérmicas revelaron la presencia de ADN del virus MPOX por PCR en tiempo real. Las pruebas inmunológicas fueron las siguientes: ELISA cuarta generación para VIH y Western Blot negativas, anticuerpos IgM para herpes simplex1=1.2 U/ml, anticuerpos IgM para herpes simplex2=1.9 U/ml, anticuerpos IgM para varicela zóster=0.5 S/CO, FTA-ABS (IgM)=negativo. Se resalta la intensidad de las lesiones cutáneas en el pene y la necesidad de realizar pruebas para descarte de MPOX en prostitutas.
Palabras clave: viruela del mono (MPOX), heterosexual, lesiones dérmicas .
Abstract: We present the case of a 28-year-old male patient, heterosexual, with negative HIV who developed an intense skin rash characterized by the presence of confluent vesicles, pustules, and umbilicated papules on the penis and pubic region with little spread to the rest of the body, without lymphadenopathy or systemic manifestations, four days after having sexual relations with an apparently healthy prostitute. The swabbing of the dermal lesions revealed the presence of MPOX virus DNA by real-time PCR. The immunological tests were the following: negative fourth-generation ELISA and Western Blot for HIV, IgM antibodies to herpes simplex1=1.2 U/ ml, IgM antibodies to herpes simplex2=1.9 U/ml, IgM antibodies to varicella zoster=0.5 S/CO and negative FTA-ABS (IgM) for syphilis. The intensity of skin lesions on the penis and the need to perform tests to rule out MPOX in prostitutes are highlighted.
Keywords: monkeypox (MPOX), heterosexual, skin lesions .
INTRODUCCIÓN
La viruela del mono (MPOX) es una enfermedad zoonótica, endémica en países de África Central y Occidental causada por un virus ADN de doble cadena, perteneciente al género orthopoxvirus y a la familia poxviridae. Tiene un tamaño de 300-400 nm x 250- 290 nm. [1] Respecto a los estudios genómicos del virus, se han identificado 286 genomas de viruela del mono en el mundo, siendo los linajes más frecuentes el B.1.1 al B.1.8. [1] Fue descrito por primera vez en la República Democrática del Congo en 1970 [2] y desde entonces se han notificado brotes esporádicos en África originados por contacto con animales silvestres, especialmente roedores. [3] Debido a la rápida propagación de casos desde mayo de este año, la OMS declaró la infección como una amenaza de salud pública en el mes junio [4] y desde el 28 de noviembre le ha puesto el nombre de “MPOX”. [5] La transmisión del virus ocurre a través de gotas respiratorias grandes, contacto con lesiones cutáneas y fómites contaminados. [6] No hay evidencia clara de transmisión sexual a través de fluidos seminales o vaginales [6] y se ha descrito transmisión vertical y muertes fetales. [7] La enfermedad suele ser autolimitada, con un periodo de incubación que varía entre 6 y 13 días y en forma característica empieza con fiebre, seguida por el desarrollo de múltiples pápulas, lesiones vesiculares-pustulosas y ulcerativas en el rostro y cuerpo acompañadas de adenopatía. La evolución de las lesiones dérmicas ocurre en el lapso de 10 a 14 días según la siguiente secuencia: máculas, pápulas, vesículas, pústulas y costras. La tasa de letalidad varía entre 1 y 10 % dependiendo de las complicaciones, que incluyen neumonía, encefalitis, queratitis y linfadenitis bacteriana secundaria. [8,9] Se ha reportado que las personas inmunodeprimidas incluyendo las portadoras de VIH tienen mayor riesgo de formas graves, aunque no está demostrado si la terapia antirretroviral modifica dicho riesgo. [7] Se ha señalado que el actual brote de la viruela del mono puede deberse a cambios biológicos del virus, disminución de la inmunidad contra la viruela, relajación de las medidas de prevención contra el COVID-19, reanudación de los viajes internacionales y la concentración de grandes reuniones sociales. [10]
Desde el 1 de enero hasta el 27 de noviembre del presente año, la OMS ha reportado un total acumulado de 81 107 casos y 55 muertes en 110 países confirmados por laboratorio de viruela del mono. Los países que en los últimos días han notificado el mayor número acumulado de casos son Estados Unidos de América (n=29,001), Brasil (n=9,905), España (n=7,405), Francia (n=4,107), Colombia (n=3,803), Reino Unido (n=3,720), Alemania (n=3,672), Perú (n=3,444), México (n=3,292) y Canadá (n=1449). Estos países juntos representan el 86.1 % de los casos notificados a nivel mundial. [11] El brote epidemiológico continúa afectando principalmente a varones jóvenes, con un 96.9 % (46,691/48,188), con una mediana de edad de 34 años (rango inter-cuartil de 29-41 años). En la región de las Américas se ha observado la mayor proporción de casos de 0 a 17 años (422/570; 74 %). [11] Respecto de la orientación sexual, el 84.8 % (24,251/28,607) se identificaron como homosexuales, bisexuales y varones que tuvieron sexo con otros hombres (HSH). De todos los modos de transmisión notificados, la transmisión más frecuente fue a través de la piel y del contacto con las mucosas durante la actividad sexual (13,904/19,609) representando el 70.9 % de todos los informes. [11] El primer caso de MPOX reportado en el Perú fue el 26 de junio de este año en un ciudadano extranjero que radica en el Perú que se habría contagiado por contacto en el exterior. [12] Desde entonces hasta el 28 de noviembre último se han reportado 3508 casos confirmados, de los cuales 2,725 (77.67 %) ocurrieron en Lima.[13] Aunque la epidemia ha estado concentrada en HSH, también puede ocurrir en personas heterosexuales, y sin que tengan una infección concomitante por VIH. Para ilustrar este hecho se presenta el siguiente reporte de caso:
REPORTE DE CASO
Paciente varón de 28 años, natural de Tumbes, procedente de Lima, residente de la ciudad de Lima desde hace 10 años, de ocupación electricista, soltero. Vive con su hermana y cuñado. Padres y 5 hermanos vivos, sanos. Tuvo COVID -19 hace 18 meses, ha recibido 3 dosis de vacuna anti-COVID, siendo la última en abril del 2022. Ignora vacunas recibidas en la infancia excepto la vacuna BCG. Niega tener alergias alimentarias y medicamentosas y no suele usar fármacos. Refiere que el 31 de octubre último visitó un prostíbulo y haber tenido relaciones sexuales por única vez con una meretriz de nacionalidad venezolana, de aproximadamente 25 años, quien aparentemente se encontraba sana, sin lesiones dermatológicas. No le mostró carné sanitario. Tuvo relaciones orales, vaginales y anales con preservativo, el cual se rompió en la relación anal. Cuatro días después de dicha relación sexual empezó a notar la presencia de pápulas y vesículas confluentes levemente dolorosas y pruriginosas en la región dorsal y ventral del pene, que se diseminaron rápidamente a la región púbica, brazo, codo y antebrazo derechos, dorso del primer dedo y palma de la mano derecha, espalda, región poplítea derecha, dorso y planta del pie derecho, tobillo y planta del pie izquierdo, región frontal y temporal derecha del rostro, cuero cabelludo y glúteo derecho, motivo por el cual acudió a un centro hospitalario donde le dieron clindamicina 300 mg cada 8 horas, doxiciclina 500 mg cada 12 horas y loratadina 10 mg. Le hicieron prueba de ELISA para HIV, la cual salió negativa. Por la persistencia de las manifestaciones dérmicas acude a otro hospital donde le indicaron los exámenes pertinentes. Suele acudir a prostíbulos con una frecuencia de 3 a 4 veces al mes. Refiere que tuvo una pareja mujer hasta hace 5 meses por un lapso de 3 meses en la ciudad de Tumbes. Negó en varias oportunidades haber tenido relaciones homosexuales. Ha realizado viajes ocasionales a la frontera con el Ecuador. Refiere haber bajado 3 kg en los últimos 15 días. Se siente levemente angustiado por sus lesiones dérmicas. Con respecto a los hábitos nocivos, manifiesta fumar ocasionalmente, ingiere alcohol en forma ocasional, con una frecuencia aproximada de una vez cada 3 meses hasta la embriaguez.
Al examen físico se aprecia buen estado general, lúcido y colaborador, peso = 69.5 kg, talla=1.66, Índice de Masa Corporal=25.27 kg/m2, SaO. =98 %, frecuencia cardiaca=74/m, presión arterial=120/60 mm Hg. Presencia de pápulas umbilicadas costrosas confluentes con leve dolor y prurito en la región dorsal y ventral del pene, región púbica, brazo, codo y antebrazo derechos, dorso del primer dedo y palma de la mano derecha, espalda, región poplítea derecha, dorso y planta del pie derecho, tobillo y planta del pie izquierdo, región frontal y temporal derecha del rostro, cuero cabelludo y glúteo derecho (Figuras 1, 2, 3). Ausencia de adenopatías en cuello, no se palpa bocio, cardiovascular: ruidos cardiacos rítmicos, de buena intensidad, ventilación pulmonar conservada, abdomen blando, depresible, ausencia de visceromegalia y puntos dolorosos.
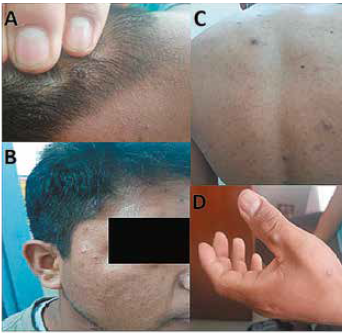
Figura 1:
Lesiones dérmicas umbilicadas en A) Cuero cabelludo B) Región temporal C) Región posterior del tórax D) Dorso de la mano izquierda.
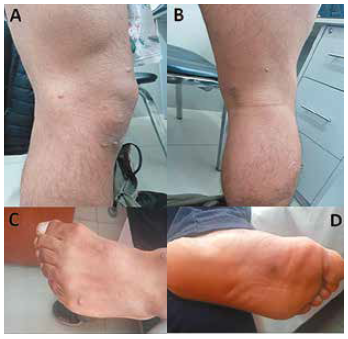
Figura 2:
Lesiones dérmicas umbilicadas en A Dorso del pene B Región ventral del pene
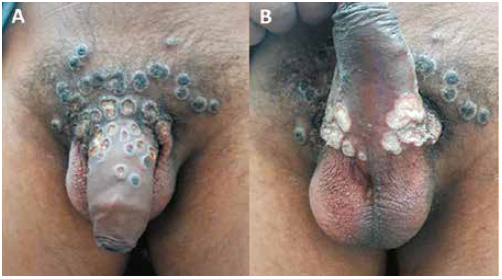
Figura 3:
Lesiones dérmicas umbilicadas en A) Dorso del pene B) Región ventral del pene.
Los exámenes auxiliares practicados son los siguientes: Hisopado de lesión dérmica (17.11.22): ADN del virus Monkeypox en muestra de piel por PCR en tiempo real=positivo. Hemograma (16.11.22): glóbulos rojos=5´430,000/mm3, hemoglobina=15.4 g/dl, hematocrito=46 %, recuento de plaquetas=294,000/mm, volumen plaquetario medio=10.4 fL, leucocitos=12,340/mm3, abastonados=0, segmentados=7.40 x 103/μL, eosinófilos=0, basófilos=0, monocitos=0.62x103/μL, linfocitos=4.32x103/μL, Índice Neutrófilo/Linfocito=1.71. Pruebas inmunológicas: ELISA cuarta generación para HIV (16.11.22) no reactivo, Western Blot negativo, anticuerpos IgM para herpes simplex 1=1.2 U/ml, anticuerpos IgM para herpes simplex 2=1.9 U/ml, anticuerpos IgM para varicela zóster=0.5 S/CO, FTA-ABS (IgM)=negativo. El paciente concedió su consentimiento informado voluntario para la publicación confidencial de su caso. Luego de 3 semanas, las lesiones se mantienen estables, sin mayores cambios, y no han ocurrido complicaciones tales como signos respiratorios inferiores, encefalitis, ni sobreinfección de las lesiones cutáneas.
DISCUSIÓN
El caso presentado ocurrió en una persona heterosexual sin VIH, presentándose con lesiones ulcerativas umbilicadas confluentes principalmente en el pene y la región inguinal sin manifestaciones mucosas, sistémicas ni adenopatías cuya evolución fue satisfactoria y manejada en forma ambulatoria con medidas sintomáticas. Las lesiones aparecieron 4 días después de haber tenido contacto sexual con una prostituta, quien aparentemente no tuvo lesiones cutáneas. Un rasgo distintivo del caso es la aparición inicial de las lesiones marcadas en el área genital con propagación rápida a otras regiones corporales. Para establecer el diagnóstico diferencial se realizaron pruebas inmunológicas que permitieron descartar sífilis, varicela zóster y herpes simplex. No se realizó pruebas para molusco contagioso. Las características dermatológicas del presente caso tienen similitud con los descritos por Basgoz y col. [14] en Boston, por Lopes en Brasil [15] que también describieron lesiones genitales semejantes, aunque de menor gravedad y con un tiempo mayor en la aparición de las lesiones. Asimismo, la distribución y aparición de lesiones es muy similar a la reportada por Maguiña-Vargas [16] en Perú en un paciente en el que no se pudo esclarecer sus prácticas sexuales.
Entre las series internacionales más grandes, podemos citar el estudio de Thornhill y col. [17] que describió 528 casos en 16 países, 98 % de las infecciones fueron varones homosexuales o bisexuales, con una mediana de edad de 38 años, 75 % de etnia blanca y 41 % con infección de inmunodeficiencia humana. El 95 % de las personas presentaron una erupción (64 % con menos de 10 lesiones), 74 % con lesiones a nivel anogenital y 41 % con lesiones mucosas. En dicha serie, las manifestaciones sistémicas que precedieron a la erupción fueron fiebre (62 %), letargia (41 %), mialgia (31 %), cefalea (27 %), adenopatía (56 %). En el 29 % se informaron transmisión sexual concomitante con un periodo de incubación de 7 días (rango de 3 a 20) sin reporte de defunciones. Otra serie grande es la publicada por Patel y col. [18] que describió el brote en la ciudad de Londres en 197 personas del sexo masculino con una mediana de edad de 38 años, de los cuales 196 (99.49 %) fueron identificados como homosexuales, bisexuales u otros hombres que tuvieron sexo con hombres. Todos presentaron lesiones mucocutáneas, más comúnmente en los genitales (56.3 %), en el área perianal (41.6 %) y 86.3 % reportaron enfermedad sistémica. Los síntomas sistémicos más comunes fueron fiebre (61.9 %), adenopatía (57.9 %) y mialgia (31.5 %), 61.5 % desarrollaron características sistémicas antes de iniciar manifestaciones mucocutáneas, 13.7 % presentaron exclusivamente manifestaciones mucocutáneas sin rasgos sistémicos, 36.0 % refirieron dolor rectal, 16.8 % dolor de garganta y 15.7 % edema de pene, 13.7 % tuvieron lesiones orales, 4.6 % signos amigdalinos, 35.9 % tuvieron infección por VIH concomitante, 31.5 % tuvieron una infección de transmisión sexual concomitante y 10.2 % fueron hospitalizados por dolor rectal intenso y edema de pene.
Otro estudio importante fue realizado por Catalá y col. [19] mediante un diseño transversal prospectivo en el brote epidémico de España iniciado en mayo de este año incluyendo a 185 pacientes consecutivos, con un promedio de edad de 38.7 años, todos varones, 42.16 % con VIH positivo. Entre las lesiones cutáneas, el 6 % tuvieron máculas, 49 % pápulas, 29 % vesículas, 75 % pústulas o seudo pústulas, el 53 % de las lesiones estuvieron localizadas en los genitales, 39 % en el rostro, 38 % en brazos y manos y 34 % en la región perianal. Entre las manifestaciones sistémicas, el 56% tuvieron adenopatías, el 54 % fiebre, 44 % astenia, 44 % mialgia, 32 % cefalea y 22 % dolor rectal. El 99 % tuvo relaciones sexuales con hombres y 4 % además con mujeres. El 34 % manifestó haber usado drogas durante las relaciones sexuales. Benites-Zapata y col. [20] en un estudio reciente de metaanálisis que incluyó 19 artículos en 1958 pacientes describieron que las manifestaciones clínicas más frecuentes fueron: erupción cutánea en el 93 % (IC 95 % 80–100 %), fiebre en el 72 % (IC 95 % 30–99 %), prurito en el 65 % (IC 95 % 47–81 %) y adenopatía en el 62 % (IC 95 % 47- 76 %), el 35 % (IC 95 % 14-59 %) fueron hospitalizados y sólo el 4 % (IC 95 % 1-9 %) tuvieron desenlaces fatales. Un estudio más reciente, publicado por Fink y col [21] enfocado en posibles complicaciones, describe que en 156 individuos hospitalizados por MPOX, 57 % tuvieron dolor severo, 58 % infección secundaria bacteriana, 10 requirieron cirugía, y hubo dos casos de encefalitis.
Entre las publicaciones nacionales, cabe mencionar al estudio de Pampa-Espinoza y col. [22] que describieron 9 casos con un promedio de edad de 42.7 años (rango de 33 a 70 años) de los cuales 7/9 fueron varones, 3/9 de nacionalidad venezolana, 2/9 con VIH positivo, 9/9 con manifestaciones sistémicas caracterizadas por fiebre, astenia y adenopatía, 9/9 con lesiones cutáneas de pápulas, vesículas y pústulas de distribución principalmente en la cabeza, rostro, brazos, manos, tórax, abdomen y sólo en 2/9 en los genitales. En dicho estudio sólo a 2/9 de pacientes les hicieron PCR para viruela del mono, 1/9 fue positivo para IgM ELISA para varicela, 1/9 tuvo RPR positivo para sífilis y ninguno fue positivo en las pruebas de IgM ELISA para sarampión y rubeóla. En el Perú, se ha registrado el 11 % de los genomas del virus y se ha identificado el linaje peruano B.1.6. que procede principalmente de la ciudad de Lima. [23] El presente caso sirve para resaltar las manifestaciones cutáneas intensas en el área genital de aparición rápida, sin manifestaciones sistémicas y sin antecedentes de relaciones homosexuales o infección por VIH. Además, resalta la necesidad de realizar pruebas de descarte de MPOX en trabajadoras(es) sexuales para reducir el riesgo de propagación de la enfermedad en la comunidad.
REFERENCIAS BIBLIOGRÁFICAS
1. Luna N, Ramírez AL, Muñoz M, Ballesteros N, Patiño LH, Castañeda SA, Bonilla-Aldana DK, Paniz-Mondolfi A, Ramírez JD. Phylogenomic analysis of the monkeypox virus (MPXV) 2022 outbreak: ¿Emergence of a novel viral lineage? Travel Med Infect Dis. 2022 Sep-Oct; 49:102402. Epub 2022 Jul 13. doi: 10.1016/j. tmaid.2022.102402.
2. Ladnyj ID, Ziegler P, Kima E. A human infection caused by monkeypox virus in Basankusu Territory, Democratic Republic of the Congo. Bull World Health Organ. 1972;46(5):593-7. PMID: 4340218; PMCID: PMC2480792.
3. Human monkeypox — Kasai Oriental, Democratic Republic of Congo, February 1996–October 1997. MMWR Morb Mortal Wkly Rep 1997. JAMA. 1998;279(3): 189-190.doi: 10-1001/pubs.JAMA-ISSN-0098- 7484-279-3-jwr0121.
4. World Health Organization. Multi-country monkeypox outbreak: situation update [Internet]. June 17, 2022 (citado 08 Dic 2022). Disponible en: https://www.who.int/emergencies/disease- outbreak-news/item/ 2022-DON393.
5. World Health Organization. WHO recommends new name for monkeypox disease [Internet]. 28 November 2022, News release Geneva, Switzerland (citado 08 Dic 2022). Disponible en: https:// www.who.int/news/item/28-11-2022-who-recommends-new- name-for-monkeypox-disease.
6. UK Health Security Agency. Monkeypox: background information [Internet]. 09 August 2022. The epidemiology, symptoms, diagnosis and management of mpox virus infections (citado 08 Dic 2022). Disponible en: https:// www.gov.uk/guidance/monkeypox# transmission.
7. Mbala PK, Huggins JW, Riu-Rovira T, Ahuka SM, Mulembakani P, Rimoin AW, Martin JW, Muyembe JT. Maternal and Fetal Outcomes Among Pregnant Women With Human Monkeypox Infection in the Democratic Republic of Congo. J Infect Dis. 2017 oct 17;216(7):824- 828. doi: 10.1093/infdis/jix260.
8. Bunge EM, Hoet B, Chen L, Lienert F, Weidenthaler H, Baer LR, et al. (2022) The changing epidemiology of human monkeypox—A potential threat? A systematic review. PLoS Negl Trop Dis 16(2): e0010141. https://doi.org/10.1371/ journal. pntd.0010141.
9. Ogoina D, Iroezindu M, James HI, et al. Clinical Course and Outcome of Human Monkeypox in Nigeria. Clin Infect Dis. 2020 Nov 5;71(8):e210-e214. doi: 10.1093/cid/ciaa143.
10. World Health Organization. Monkeypox [Internet]. 19 May 2022. Key facts (citado 08 Dic 2022). Disponible en: https://www.who. int/news-room/fact-sheets/detail/monkeypox).
11. World Health Organization. Multi-country outbreak of MPOX, External situation report #11 1-December-2022 [Internet] (citado 08 Dic 2022). Disponible en: https://www.who.int/publications/m/ item/multi-country-outbreak-of-MPOX--external-situation-report-11 1-december-2022.
12. Ministerio de Salud- Perú. MINSA confirma primer caso de la viruela del mono en el Perú [Internet]. (citado 08 Dic 2022). Disponible en: https://www.gob.pe/institucion/minsa/noticias/627040-minsa- confirma-primer-caso-de-la-viruela-del-mono-en-el-peru.
13. CDC-Peru. Sala Situacional de la Viruela del Mono [Internet]. (citado 08 Dic 2022). Disponible en: https://www.dge.gob.pe/ sala-monkeypox.
14. Basgoz N, Brown CM, Smole SC, Madoff LC, Biddinger PD, Baugh JJ and Shenoy ES. Case 24-2022: A 31-Year-Old Man with Perianal and Penile Ulcers, Rectal Pain, and Rash. N Engl J Med 2022; 387:547-56. DOI: 10.1056/NEJMcpc2201244.
15. Lopes PS, Haddad GR, Miot HA. Sexually-transmitted monkeypox: report of two cases. An Bras Dermatol. 2022 nov-dec;97(6):783-785. Epub 2022 Sep 20. doi: 10.1016/j.abd.2022.08.002.
16. Ciro Maguiña-Vargas C, Gastelo-Acosta R, Espinal-Ramírez M. Un caso autóctono de viruela de mono en Lima. Rev Soc Peru Med Interna 2022; 35(3): 115-118. https://doi.org/10.36393/spmi. v35i3.681.
17. Thornhill JP, Barkati S, Walmsley S, Rockstroh J, Antinori A, Harrison LB et al. Monkeypox Virus Infection in Humans across 16 Countries
18. Patel A, Bilinska J, Tam JCH, Da Silva Fontoura D, Mason CY, Daunt A, et al. Clinical features and novel presentations of human monkeypox in a central London centre during the 2022 outbreak: descriptive case series. BMJ. 2022 jul 28;378: e072410. doi: 10.1136/bmj-2022-072410.
19. Catalá A, Clavo-Escribano P, Riera-Monroig J, Martín-Ezquerra G, Fernandez-Gonzalez P, Revelles-Peñas L, et al. Monkeypox outbreak in Spain: clinical and epidemiological findings in a prospective cross- sectional study of 185 cases. Br J Dermatol. 2022 nov;187(5):765- 772. Epub 2022 Aug 20. doi: 10.1111/bjd.21790.
20. Benites-Zapata VA, Ulloque-Badaracco JR, Alarcon-Braga EA, Hernandez-Bustamante EA, Mosquera-Rojas MD, Bonilla-Aldana DK, et al. Clinical features, hospitalization and deaths associated with monkeypox: a systematic review and meta-analysis. Ann Clin Microbiol Antimicrob. 2022 Aug 10;21(1):36. doi: 10.1186/s12941- 022-00527-1.
21. Fink DL, Callaby H, Luintel A, Beynon W, Bond H, Lim EY, et al. Clinical features and management of individuals admitted to hospital with monkeypox and associated complications across the UK: a retrospective cohort study. Lancet Infect Dis. 2022 Dec 22:S1473-3099(22)00806-4. Epub ahead of print. doi: 10.1016/ S1473-3099(22)00806-4.
22. Pampa-Espinoza L, Meza K, Vargas-Huapaya M, Borgoño N, Martínez-Paredes C, Padilla-Rojas C, et al. Características de los primeros casos reportados como sospechosos de Monkeypox en el Perú. An Fac med. 2022;83(3):228-34. DOI: https://doi. org/10.15381/anales. v83i3.23220.
23. Instituto Nacional de Salud. INS identificó un linaje peruano del virus de la viruela del mono designado B.1.6 [Internet]. 04 Septiembre 2022 (citado 08 Dic 2022). Disponible en: https://web.ins.gob.pe/ es/prensa/noticia/ins-identifico-un-linaje-peruano-del-virus-de-la- viruela-del-mono-designado-b16.
Notas de autor
ninoskabf@hotmail.com