Artículos Originales
Variación de la calidad de vida en pacientes con Síndrome de Apnea Hipopnea Obstructiva del Sueño luego del tratamiento con dispositivo de avance mandibular
Variation of quality of life in patients with Obstructive Sleep Apnea Hypopnea Syndrome after treatment with mandibular advance device
Variación de la calidad de vida en pacientes con Síndrome de Apnea Hipopnea Obstructiva del Sueño luego del tratamiento con dispositivo de avance mandibular
Acta Médica Peruana, vol. 39, núm. 4, pp. 344-351, 2022
Colegio Médico del Perú

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
Recepción: 02 Junio 2022
Aprobación: 01 Diciembre 2022
Resumen: Objetivo: Determinar la variación de la calidad de vida en pacientes con Síndrome de Apnea Hipopnea Obstructiva del Sueño leve moderado, luego del tratamiento con Dispositivo de Avance Mandibular a una altitud de 3259 msnm. Métodos: Estudio prospectivo, cuasi-experimental. Se incluyeron sujetos con índice de Disturbio Respiratorio (IDR) entre 5 y 30 /hora (medido con poligrafía respiratoria), sin tratamientos previos, que presentaban condiciones para el uso del DAM. Se valoró calidad de vida con el FOSQ (Functional Outcomes Sleep Questionnaire) antes y después de 45 días de tratamiento con DAM. Resultados: 26 completaron el estudio (20 varones). La media (DE) de edad fue: 43 (9.6) años, IMC: 29 (8.6) kg/m2 e IDR: 19 (7.6) /h. Luego de 45 días, se observaron cambios significativos, en el FOSQ (total, dimensiones de productividad general, producción social, nivel de actividad, vigilia y relaciones íntimas/actividad sexual) p <0.001. La media del IDR descendió de 19 (7.6) a 7 (3.8) (p <0.001), la desaturación mínima de O2 incrementó de 77 % (5.2) a 83 % (3.9) (p <0.001), el T90 descendió de 73 % (15.4) a 31 % (16.6) (p <0.001) y el Epworth disminuyó de 11.2 (4.6) a 6.4 (3.5) (p <0.001). Conclusiones:En pacientes con SAHOS leve - moderado el tratamiento con DAM produce mejoría significativa en su calidad de vida, reduce nivel de enfermedad expresado en descenso del IDR, mejora el nivel oxigenación y reduce la somnolencia diurna expresado en disminución del puntaje Epworth.
Palabras clave: Apnea Obstructiva del Sueño, Calidad de Vida, Trastornos de Somnolencia Excesiva, Avance Mandibular.
Abstract: Objective: To determine the variation of the Quality of Life in patients with mild to moderate Obstructive Sleep Apnea Hypopnea Syndrome, after treatment with the Mandibular Advancement Device at an altitude of 3259 masl. Methods: Prospective, quasi-experimental study. Subjects with respiratory disturbance index (RDI) between 5 and 30 / hour (measured with respiratory polygraphy), without previous treatments, with conditions for the use of MAD were included. The quality of life was assessed with the FOSQ (questionnaire of functional sleep results) before and after 45 days of treatment with MAD. Results: 26 completed the study (20 males). The mean (SD) of the age was 43 (9.6) years, BMI was 29 (8.6) kg / m2, and the RDI was 19 (7.6) / hour. After 45 day, significant changes were observed, with respect to the baseline values, in the FOSQ score (total calculation, general productivity, social outcome, activity level, vigilance and intimate relationships/sexual activity, p <0.001). The mean RDI decreased from 19 (7.6) to 7 (3.8) (p <0.001), the minimum desaturation of O2 increased from 77 (5.2) to 83 (3.9) (p <0.001), the T90 decreased from 73 (15.4) to 31 (16.6) (p <0.001) y Epworth's score decreased from 11.2 (4.6) to 6.4 (3.5) (p <0.001). Conclusions: In patients with mild-moderate OSA, treatment with MAD produces significant improvement in their quality of life, reduces the level of disease expressed in decreased RDI, improves oxygenation level and reduces daytime sleepiness expressed in decreased Epworth score.
Keywords: Obstructive Sleep Apnea, Quality of Life, Disorders of Excessive Somnolence, Mandibular Advancement.
INTRODUCCIÓN
El Síndrome de Apnea Hipopnea Obstructiva del Sueño (SAHOS) es definido por la Academia Americana de Medicina del Sueño como una enfermedad que se caracteriza por episodios repetitivos de obstrucción total (apnea) o parcial (hipopnea) de la vía aérea superior durante el dormir. Estos eventos producen una disminución de la saturación de oxígeno en sangre y terminan en un breve despertar o alertamiento. [1] Afecta a casi mil millones de adultos entre 30 a 69 años con o sin síntomas a nivel mundial, de estos, 425 millones (> 45 %) tenían enfermedad moderada a grave, la prevalencia del SAHOS tiene una variación geográfica que alcanza hasta el 50 % en algunos países. Las estimaciones para Perú reportan 12 928 630 individuos de 30 y 69 años, la prevalencia de SAHOS en esta población fue de 53,2 % (6 873 395), de SAHOS moderada a grave fue de 26,9 % (3 482 848). [2] Un estudio realizado en Lima, encontró una frecuencia de riesgo de padecer SAHOS de 66,9 % y 62,6 % en pacientes roncadores, con la escala SACS (Sleep Apnea Clinical Score) y el cuestionario Berlín respectivamente. [3]
El diagnóstico de esta condición es complejo y la historia clínica realizada por un especialista en sueño, puede alcanzar una sensibilidad de 64 %. [4] Actualmente la polisomnografía constituye el estándar para establecer el diagnóstico; sin embargo, esta consume mucho tiempo, no es universalmente accesible y genera costos elevados. [5] En la actualidad existen métodos simplificados válidos como la poligrafía respiratoria, [6,7] aceptado como abordaje diagnóstico del SAHOS, porque ha demostrado ser comparable a la polisomnografía, siendo su exactitud diagnóstica superior al 90 % [8-10], también es aceptada para el seguimiento de intervenciones como reducción de peso, terapia posicional, dispositivo de avance mandibular o dispositivos de presión positiva. [11,12].
La Somnolencia Diurna Excesiva (SDE) es el síntoma de mayor relevancia, se define como la dificultad para permanecer despierto y alerta durante el día, lo que produce lapsos imprevistos de somnolencia o sueño. La SDE se relaciona con un incremento en el riesgo de accidentes de tránsito y laborales, déficits en la atención y concentración, dificultad en la orientación, alteraciones de la memoria y estado de ánimo, fatiga, cefalea matutina, entre otros. [13] Existen varias escalas para medir la SDE, pero la más utilizada es la Escala de Somnolencia de Epworth (ESE), consta de 8 preguntas relacionadas con la tendencia de dormirse en situaciones cotidianas [14,15], cuantifica el nivel de somnolencia, pero no valora el impacto que provoca en su calidad de vida. Existe una validación peruana de ESE. [16]
Los cuestionarios de Calidad de Vida (CV) nos permiten valorar las consecuencias en las actividades cotidianas, sociales, de funcionalidad, vigilia e intimidad, debidas a la SDE. Existen varias escalas para población adulta [17-19] y niños [20]. El Cuestionario de Consecuencias Funcionales del Dormir o FOSQ (Functional Outcomes Sleep Questionnaire), se diseñó para medir el impacto de la SDE sobre el desempeño conductual cotidiano en las áreas física, psicológica y social. [21] El FOSQ tiene amplia difusión en el campo de la medicina del sueño y se han probado sus propiedades psicométricas en países como España y Suecia [22, 23]. Víctor Rodríguez-Pérez y col en 2013, desarrollaron una adaptación para población latina, con habitantes de la Ciudad de México. [25]
Los Dispositivos de Avance mandibular son aparatos que se introducen en la boca y modifican la posición de la mandíbula, la lengua y otras estructuras de la vía aérea superior para el tratamiento del ronquido y/o el SAHOS. Son una alternativa válida de primera elección para roncadores simples, pacientes con enfermedad leve-moderada con bajo índice de masa corporal (IMC), como segunda elección en quienes no responden o rechazan los aparatos de presión positiva y pacientes con riesgo quirúrgico elevado o con deficiente respuesta al tratamiento quirúrgico. [26, 27]
El SAHOS altera la calidad de vida y genera consecuencias sobre sus actividades cotidianas, laborales, sociales, nivel de actividad e intimidad. Los DAM se muestran efectivos en el tratamiento al reducir significativamente el nivel de enfermedad en términos del IAH y podrían mejorar también la calidad de vida, nivel de oxigenación y grado de somnolencia.
En nuestro medio existen muchos pacientes con SAHOS que se encuentran sin intervención, no existen laboratorios de sueño en las instituciones públicas y los privados ofrecen servicios de diagnóstico y tratamiento poco accesibles por el alto costo; es por ello que se justifica utilizar métodos simplificados, como la Poligrafía Respiratoria en el diagnóstico y DAM en el tratamiento.
El objetivo del estudio fue determinar la variación de la calidad de vida en pacientes con Síndrome de Apnea Hipopnea Obstructiva del Sueño leve moderado, en términos de: productividad general, producción social, nivel de funcionalidad, vigilia e intimidad, luego del tratamiento con Dispositivo de Avance Mandibular a una altitud de 3259 msnm.
MÉTODOS
Estudio de intervención, prospectivo, cuasi experimental (de antes y después), con sujetos que fueron seleccionados de la consulta externa en un hospital público ubicado a 3 259 msnm, con síntomas y sospecha clínica, a quienes se les realizó una poligrafía respiratoria para confirmar el SAHOS. Se incluyeron pacientes con un Índice de Disturbio Respiratorio (IDR) de ≥ 5 y ≤ 30 eventos/h, de 18 a 60 años de edad, ambos sexos, sin tratamientos previos para SAHOS, con capacidad de adelantar la mandíbula (situar el arco dentario inferior unos 4 o 5 milímetros por delante del arco dentario superior) y abrirla sin limitaciones significativas (apertura máxima mandibular mayor a 40 mm), dentición suficiente para dar estabilidad al dispositivo (mínimo 8 dientes por maxilar), que comprendan y puedan responder los cuestionarios y acepten las condiciones del consentimiento informado. Excluidos aquellos con patología rinofaríngea crónica, epilepsia, alteraciones odontológicas (menos de 2 dientes sanos en los sectores posteriores, movilidad dentaria grave, enfermedad periodontal activa sin tratamiento), problemas en articulación temporomandibular (ATM), facilidad de náuseas, excesiva sobre mordida (superposición de los dientes anterosuperiores sobre los anteroinferiores en el plano vertical superior al 40 %) y macroglosia.
Para el cálculo del tamaño muestral se utilizó una estimación basada en una diferencia de proporciones del 20 % en base a una potencia estadística del 80 % y un nivel de confianza del 95 %. La muestra requerida para datos apareados calculada con Stata 13.0 y considerando las posibles pérdidas en el seguimiento o la presencia de datos incompletos, fue de 28 pacientes. Las variables fueron calidad de vida y se dimensionó en óptima (mayor de 18 puntos), regular (entre 16 y 18 puntos) y deficiente (menor de 16 puntos), el IDR en mejorado (Disminución del 50 % del IDR basal o reducción del IDR a ≤5) y no mejorado y la somnolencia con SDE (Epworth >10) y sin SDE (Epworth ≤ 10).
La calidad de vida se determinó con el FOSQ que consta de 30 preguntas divididas en 5 subescalas a) productividad general (8 preguntas: de la 1 -4 y 8-11), b) producción social (2 preguntas: 12 y 13), c) nivel de actividad (9 preguntas: 5, 14 - 16 y 22 - 26), d) vigilia (7 preguntas: 6,7 y 17 - 21) y e) relaciones íntimas/ actividad sexual (4 preguntas: de la 27 - 30), donde se contesta, si tiene dificultad para realizar determinadas actividades porque está cansado o somnoliento. Tiene cinco opciones de respuesta: 0 (esta actividad no la hago por otras razones), 1 (sí, extremadamente), 2 (sí, moderadamente), 3 (sí, poco) y 4 (no). [21] Para las subescalas el rango potencial de puntajes es de 1 – 4. La puntuación total va de 5 -20. El estudio utilizó la validación de Víctor Rodríguez- Pérez y col. para población latina [25]. Para SDE se utilizó la escala de Epworth, validada al español [16]. Considerando un puntaje patológico aquel que superaba los 10 puntos [14].
La poligrafía respiratoria fue realizada y analizada de forma manual siempre por el investigador principal, utilizando los criterios de Academia Americana de Medicina del Sueño, se registraron las variables como el flujo de aire nasal, movimientos torácicos, SatO2, frecuencia cardiaca y ronquido. El IDR se obtuvo de dividir los eventos respiratorios entre el tiempo de registro, los parámetros de diagnóstico fueron: IDR <5/h: normal, de 5 a 15/h: leve, de 16 a 30/h: moderada y >30/h: grave, [24]. El procedimiento se realizó de noche, en el domicilio del paciente con 6 horas de registro como mínimo. Se utilizó el ApneaLink Plus de ResMed, validado para el cribado de pacientes con SAHOS. [28]
Se utilizó un dispositivo de avance mandibular que consta de dos fundas de acrílico individuales para la arcada superior e inferior, autoajustables que encajan y se mantienen en los dientes. Se conectan a través de un conjunto de arcos dorsales y tubos telescópicos que posibilitan la movilidad mandibular y la estabilidad del aparato. El modelo que se utilizó tiene aprobación por la FDA, [29] se confeccionó un dispositivo para cada paciente, según las características dentales individuales. (Figura 1)
El estudio se realizó en 2 fases, la primera fase de diagnóstico donde se recogieron las variables clínicas generales (edad, sexo, índice de masa corporal [IMC] en kg/m2, perímetro de cuello, Mallampati), valoración de somnolencia con la ESE, calidad de vida con el FOSQ e IDR con el polígrafo respiratorio. Los pacientes con SAHOS leve o moderado fueron derivados al consultorio de odontología, de cumplir criterios dentales se les tomó las impresiones dentarias en modelos de yeso y se determinó el máximo avance mandibular en milímetros, luego se utilizó el 70 % de esta medida en cada paciente. El avance mandibular utilizado no tuvo variación desde el inicio hasta el final de la intervención. El DAM fue fabricado en un promedio de 7 días, luego instalado y adaptado. El DAM debía ser usado mínimamente 5 noches por semana, 6 horas por noche, y sólo para dormir, además se le dio indicaciones acerca de la instalación, retiro y mantenimiento en casa.
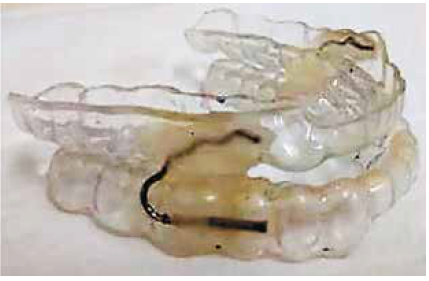
Figura 1.
Dispositivo de Avance Mandibular
En la segunda fase, de intervención, los pacientes utilizaron el DAM por 15 días, luego se determinó el nivel de aceptabilidad (comodidad y efectos adversos) mediante una escala analógica visual valorada de 0–10 considerando: 0: ninguna incomodidad y 10: mayor nivel de incomodidad y los efectos adversos 0: ningún efecto y 10: máximo nivel de malestar. Los pacientes con adecuada aceptabilidad al uso del dispositivo continuaron el tratamiento durante un mes y se les realizó nuevamente el FOSQ, ESE y una poligrafía respiratoria utilizando el DAM. Además, se registraron datos finales de aceptabilidad. Los pacientes no fueron sometidos a otras intervenciones.
El análisis estadístico se realizó con el software STATA versión 13.0. Los datos se registraron calculando la media, desviación estándar y extremos para las variables cuantitativas, y se determinaron la frecuencia y porcentajes para las cualitativas. Las comparaciones de los puntajes del FOSQ total y las subescalas, entre los datos de inicio y control a los 45 días se establecieron aplicando Wilcoxon para datos apareados, para el IDR y Epworth se aplicó la prueba paramétrica (T de Student), para las comparaciones de porcentajes se utilizó chi 2. La Escala de Stanones se utilizó para clasificar los puntajes totales del FOSQ en óptima, regular y deficiente calidad de vida. Considerando un nivel de significancia p<0,05.
Los pacientes fueron informados detalladamente acerca de la investigación, los posibles efectos colaterales y los beneficios del uso del DAM. Se tomó en cuenta los principios éticos, el respeto a la voluntad de participar en la investigación, la confidencialidad, el anonimato y la posibilidad de retirarse del estudio si el paciente lo creía conveniente. El estudio fue revisado y autorizado para su ejecución por el comité de ética de la Universidad Peruana Cayetano Heredia, con No constancia 709-22-17 de fecha 14/11/17. Dicho comité cuenta con registro y acreditación por el Instituto Nacional de Salud: RCEI-14. Los pacientes firmaron un consentimiento informado.
RESULTADOS
El estudio inició en marzo de 2018 y culminó en febrero 2019, se evaluaron 46 pacientes de los cuales 13 (28 %) fueron excluidos por la evaluación odontológica (12 casos por falta de piezas dentales y 1 por patología de ATM) y 5 (11 %) por presentar IDR ≥ 30/h. Los 28 pacientes restantes ingresaron al estudio. Dos pacientes se perdieron en el seguimiento (7 %) por causas desconocidas. Por tanto, 26 pacientes completaron las dos fases, los datos clínicos y epidemiológicos se describen en la Tabla 1.
El valor medio (DE) del avance mandibular máximo obtenido fue de 9.5 mm (1.1) con límites extremos de 8 – 12 mm, la medida para el tratamiento (70 % del máximo avance) fue de 6.3 mm (0.8) y extremos de 5 – 7 mm.
| VARIABLES | Media (DE) | Rango |
| N | 26 | – |
| Demográficas | ||
| Edad, años | 43 (9.6) | 20 – 60 |
| Género: M / F, n (%) | 17 (65) / 9 (35) | |
| Antropométricas | ||
| Índice de masa corporal, Kg/cm2, | 29 (8.6) | 18 – 40 |
| Perímetro de Cuello, Mediana (RIQ) | 42 (39-42) | 30 – 45 |
| Clasificación de Mallampati, n (%) | ||
| I | 2 (8) | – |
| II | 10 (38) | – |
| III | 1 (4) | – |
| IV | 13 (50) | – |
| Apnea del sueño | ||
| IDR, No eventos/hora registro | 19 (7.6) | 5.4 – 29.8 |
| SatO2Hb % | (1.9) | 90 – 97 |
| Desaturación máxima O2 % | 77(5.2) | 67 – 85 |
| T90 | 73 (15.4) | 30 – 93 |
| SAHOS Leve, n (%) | 9 (35) | – |
| SAHOS Moderado, n (%) | 17 (65) | – |
| Epworth puntaje | 11.2 (4.6) | 4 – 21 |
| Calidad de Vida (FOSQ) | ||
| Productividad General | 3.4 (0.4) | 2.3 – 4 |
| Producción Social | 3.5 (0.5) | 2 – 4 |
| Nivel de Actividad | 3.3 (0.4) | 2.6 – 3.9 |
| Vigilia | 3.3 (0.4) | 2.6 – 4 |
| Relaciones íntimas y Actividad Sexual | 3.5 (0.5) | 2.8 – 4 |
| FOSQ, Total | 17 (1.5) | 13.2 – 19.7 |
| Variable | Basal media (DE) | A los 45 días de Uso del DAM media (DE) | Valor de p |
| IDR, No eventos/hora registro | 19 (7.6) | 7 (3.9) | <0.001 |
| Desaturación máxima O2 % | 77 (5.2) | 83 (3.9) | <0.001 |
| T90 | 73 (15.4) | 31 (16.6) | <0.001 |
| Comparación de severidad de SAHOS | <0.001 | ||
| SAHOS Moderado, n (%) | 17 (65) | 1 (3.9) | |
| SAHOS Leve, n (%) | 9 (35) | 16 (61.5) | |
| Normal, n (%) | 0 (0) | 9 (34.6) | |
El IDR medio (DE) de los pacientes fue 19 (7.6), luego de 45 días de uso del DAM se realizó poligrafía de control y el IDR medio disminuyó a 7 (3.8) (p< 0,001), también se identificaron cambios significativos en la desaturación máxima O2 %, el tiempo porcentual de registro con SatO2Hb menor de 90 % (T90). La efectividad del DAM, considerada como objetivo (disminución en 50 % del IDR inicial) se logró en 21 casos (81 %), los pacientes con SAHOS moderada fueron 17 (65 %), el resto leves (Tabla 2).
Los datos de calidad de vida, valorados con el FOSQ (Tabla 3), muestran cambios significativos en la puntuación total y las subescalas (p < 0,001). Utilizando la Escala de Stanones los pacientes fueron clasificados en CV: Óptima 6 pacientes (23 %), regular 18 (69 %) y deficiente 2 (8 %), luego de la intervención 19 pacientes (73 %) indicaron mejoría en su calidad de vida: 17 pasaron de regular a óptima y 2 de deficiente a óptima, en 7 pacientes no hubo cambios. (Tabla 4)
Los puntajes del Epworth también mostraron cambios significativos, la media (DE) del Epworth basal fue de 11.2 (4.6) y luego del tratamiento bajó a 6.4 (3.5), se identificaron 15 casos (58 %) con SDE (puntaje de Epworth >10) y posterior a la intervención se redujo a 4 casos (15 %). El análisis considerando el género (hombre/mujer) y obesidad por IMC (< 30 / ≥ 30) no modificó los resultados de comparar el IDR, FOSQ y el puntaje Epworth basal y el final.
En relación con la aceptabilidad y uso del DAM, los pacientes indicaron una mediana de nivel de utilización de 6 (5-7) días por semana. La mediana de horas de uso por noche fue de 6h (5-7). La mediana de incomodidad referida fue de 2.5 (1-3) a los 15 días de adaptación, el nivel de incomodidad final fue de 0.5 (0-2). En 3 pacientes (11.5 %) se identificó un nivel de incomodidad de 5 a 6 puntos a los 15 días, por excesiva salivación, en el control a los 45 días el 100 % de los pacientes indicaron un nivel de incomodidad menor a 5 puntos y 13 casos (50 %) no presentaron molestia al cierre del seguimiento.
DISCUSIÓN
Los Dispositivos de Avance Mandibular (DAM) han logrado reducir significativamente el nivel de enfermedad en pacientes con SAHOS leve – moderado, muchos estudios apoyan su utilización, Sara Serra-Torres y col. En una revisión sistemática determinaron la efectividad de los DAM en 18 estudios, estos mostraron una reducción significativa de enfermedad entre el 21 % y 80 % de los pacientes. Además de una disminución en 50 % del IAH inicial o un cambio de severo – moderado a leve [26]. Joaquín Duran y col, lograron una reducción del IAH de 15.3±10.2 a 11.9±15.5 eventos /h y disminución del 50 % del nivel de IAH en 46.2 % de los pacientes [27]. Doff MH y col. Redujeron el IAH de 39±31 a 2 (0-10) eventos/h luego de 2 meses de tratamiento con DAM [30].
| Variable | Basal media (DE) | A los 45 días de Uso del DAM media (DE) | p, valor |
| FOSQ, Productividad General | 3.4 (0.4) | 3.8 (0.2) | <0.001 |
| FOSQ, Producción Social | 3.5 (0.5) | 4 (0.1) | 0.002 |
| FOSQ, Nivel de Actividad | 3.3 (0.4) | 3.7 (0.3) | <0.001 |
| FOSQ, Vigilia | 3.3 (0.4) | 3.8 (0.3) | <0.001 |
| FOSQ, Relaciones íntimas y Actividad Sexual | 3.5 (0.5) | 3.9 (0.2) | 0.001 |
| FOSQ, Total | 17 (1.5) | 19 (3.5) | <0.001 |
| Variable | Basal media (DE) | A los 45 días de Uso del DAM media (DE) | p, valor |
| FOSQ, Total | 17(1.5) | 19(3.5) | <0.001 |
| Comparación de la Calidad de Vida | <0.001 | ||
| Calidad de Vida Óptima, n (%) | 6 (23) | 25 (96) | |
| Calidad de Vida Regular, n (%) | 18 (69) | 1 (4) | |
| Calidad de Vida Deficiente, n (%) | 2 (8) | 0 (0) | |
Cálculo de los puntos de corte para clasificar la calidad de vida:
Media = 17.05, DE = 1.49
a = 17.05 – 0,75 (1.49) = 16
b = 17.05 + 0,75 (1.49) = 18
Clasificación de calidad de vida:
· Calidad Óptima: mayor de 18 puntos
· Calidad Regular: entre 16 y 18 puntos
· Calidad Deficiente: menor de 16 puntos
Por tanto, existe suficiente evidencia científica que demuestra su beneficio [37]. Los valores encontrados en este estudio reafirman esa efectividad, se logró una reducción significativa del IDR luego de los 45 días de tratamiento y se consiguió una disminución del IDR inicial en más del 50 % o normalización al término del seguimiento en 21 pacientes.
Los datos relacionados con el incremento de los valores de la desaturación máxima O2 % y la disminución del T90 evidencian mejoría significativa en el nivel de oxigenación, no se encontraron estudios similares en altitud igual o superior a los 2 000 msnm, sería el primero que se realizó a 3 259 msnm. Los valores iniciales de la desaturación máxima O2 % (77(5.2) %) y el T90 (73 (15.4) %) se encontraron por debajo del promedio observado en estudios a nivel del mar así: Phillips y col. reportaron: desaturación máxima O % en 82.7 (7.6) % y T90 en 5.4 (8.8) % [37], Durán-Cantolla y col. informaron: desaturación máxima O2 % en 87.1 (4.4) % y T90 en 3.2 (13.8) % sin cambios significativos de estos valores luego de 12 semanas de tratamiento con DAM [27], Boyd SB y col. reportaron: desaturación máxima O % en 82.7 (7.6) % [31]. El nivel de oxigenación será menor a mayor altitud y empeorará en los que padecen SAHOS, así Nussbaumer-Ochsner y col. en pacientes con SAHOS reportaron una SatO2Hb-nocturna% mediana (RIQ) a 490 msnm de 94 % (93–95), a 1860 msnm 90 % (88–91) y con 2590 msnm 87 % (84–89) [38].
El propósito de esta investigación fue demostrar que el tratamiento con DAM genera variaciones significativas en la calidad de vida de los pacientes con SAHOS leve o moderada, utilizando el FOSQ. Los cambios en la puntuación total (2 puntos de variación) y las relacionadas con dimensiones de productividad general, producción social, nivel de actividad, vigilia y relaciones íntimas/actividad sexual, antes y después de 45 días de la intervención, fueron significativos. Otros estudios que utilizaron el FOSQ también encontraron cambios significativos, por ejemplo: Doff MH y col. tras un tratamiento de 2 años con CPAP hallaron un cambio medio de 3.2 [30], Boyd, S y col. después del tratamiento quirúrgico de avance mandibular con seguimiento a 2 años el cambio fue de 4.7 [31], Lye KW y col. evaluaron pacientes con tratamiento quirúrgico después de 6 meses el cambio fue de 4.5 [32]. Luego de un régimen de ejercicio por 24 semanas el cambio medio significativo fue de 1.9. [33]. Los dispositivos de avance mandibular al igual que otras intervenciones, también logran mejoría en términos de calidad de vida.
La evaluación de la calidad de vida de pacientes con SAHOS se puede determinar utilizando distintas dimensiones y cuestionarios. Un estudio donde el DAM fue comparado con Uvulopalatofaringoplastia encontró variaciones significativas en la vitalidad, grado de satisfacción y calidad de sueño a un año de seguimiento. [34] En pacientes que habían rechazado tratamiento con CPAP los DAM demostraron reducciones significativas de la somnolencia en 60 % de los casos (Epworth), de la depresión en 53 % (medido con cuestionario Beck) y 83 % mejoraron en el índice de calidad de vida (Cuestionario Flemons). [35]. También se encontraron variaciones significativas en calidad de sueño, desempeño cognoscitivo matutino y tiempo de reacción luego del tratamiento con un Dispositivo de Reposicionamiento mandibular [36].
Clasificando los casos con la escala de Stanones se pudo observar cambios importantes en 19 pacientes (73 %), 17 pasaron de referir calidad de vida regular a óptima y 2 pasaron de calidad de vida deficiente a óptima. Analizando la media del puntaje total del FOSQ podemos observar, que el total de participantes referían calidad de vida regular al inicio y ese total pasó a calidad de vida óptima luego de la intervención con el DAM. El uso de Stanones demostró de manera objetiva la mejoría reportada, no se encontraron estudios relacionados que utilizaran esta escala en el análisis de datos de pacientes en tratamiento con DAM u otras intervenciones.
La Somnolencia Diurna Excesiva (SDE) es uno de los síntomas diurnos más frecuentes del SAHOS en la población general, es un problema recientemente reconocido y poco diagnosticado, presente con mayor frecuencia en casos graves [13]. Nuestro estudio incluyó pacientes con enfermedad leve-moderada, se esperaba encontrar cifras bajas de SDE, pero el resultado fue diferente, 15 casos (58 %), se identificaron con SDE, de estos luego del tratamiento con DAM, 11 casos (73 %) redujeron el nivel de gravedad, esta información reafirma la mejoría de los sujetos estudiados, no solo en términos de IDR y calidad de vida, sino también en reducción de la Somnolencia, otros estudios también reportaron cambios significativos en puntajes de Epworth utilizando dispositivos orales [30] y cirugía [31].
El DAM fue bien tolerado y altamente utilizado con una mediana de 6h /noche y frecuencia de 6 días/semana, resultados comparables con estudios como el de Esteller-More E. y col. quienes reportaron uso de 7.5±1.1 h/noche y 6,5 días/semana y buen nivel de comodidad, [39] Ferguson KA y col. concluyeron que el tratamiento con DAM es eficaz en SAHOS leve-moderado y se asocia a mayor comodidad y menos efectos adversos comparados con los usuarios de CPAP. [26], Los efectos adversos más frecuentes son salivación excesiva, dolor dental, alteraciones en la mordida y trastornos temporomandibulares, los cuales podrían interrumpir el tratamiento o cumplimiento adecuado [27]. La principal molestia referida en nuestro estudio fue la excesiva salivación (n = 3, 11.5 %), la mayoría de los efectos adversos son transitorios, pero en algunos casos puede haber consecuencias dentales permanentes, Hamoda et al. realizaron un seguimiento de 12,6 años (rango: 8-21 años) en 62 pacientes tratados con DAM, encontrando cambios dentales significativos y progresivos como retroclinación del incisivo maxilar y una inclinación del incisivo mandibular [40]. Las limitaciones fueron el deficiente cuidado dental (12 de los 46 casos evaluados no contaban con piezas dentales suficientes) y la inherente subjetividad de los cuestionarios usados. No se realizó polisomnografía, pero considerando las dificultades para su aplicación, la poligrafía fue una alternativa útil para evaluar los resultados de la intervención. En conclusión, se demuestra que el tratamiento con DAM mejora la calidad de vida de los pacientes con SAHOS leve-moderado, reduce significativamente el IDR, mejora el nivel de oxigenación y disminuye el nivel de somnolencia valorado con la ESE. La aceptabilidad del DAM y el nivel de cumplimiento fueron adecuados. Se recomienda la incorporación del DAM, en el arsenal terapéutico del SAHOS leve-moderado, se requieren estudios con mayor número de participantes y también con casos graves que no toleren CPAP o que requieran ambos tratamientos.
REFERENCIAS BIBLIOGRÁFICAS
1. American Academy of Sleep Medicine. International classification of sleep disorders. Diagnostic and coding manual. 2nd ed. Westchester, Illinois: American Academy of Sleep Medicine; 2005:51. ISBN: 0965722023. OCLC: 67281425.
2. Benjafield AV, Ayas NT, Eastwood PR, Heinzer R, Mary I, Morrell MJ, et al. Estimation of the global prevalence and burden of obstructive sleep apnea: A literature-based analysis. Lancet Respir Med 2019; 7: 687-98. DOI: 10.1016/S2213-2600(19)30198-5.
3. Chávez-Gonzáles César, Soto T. Alonso. Evaluación del riesgo de síndrome de apnea obstructiva del sueño y somnolencia diurna utilizando el cuestionario de Berlín y las escalas Sleep Apnea Clinical Score y Epworth en pacientes con ronquido habitual atendidos en la consulta ambulatoria. Rev. Chil Enferm Respir 2018; 34 (1): 19-27. DOI: 10.4067/s0717-73482018000100019.
4. Haponik EF, Smith PL, Meyers DA, Bleecker ER. Evaluation of sleep- disordered breathing. Is polysomnography necessary? Am J Med 1984; 77: 671-677. DOI: 10.1016/0002-9343(84)90361-9.
5. Rosenthal L D, Colan D C. The Epworth sleepiness scale in the identification of obstructive sleep apnea. J Nerv. Ment. Dis. 2008; 196: 429-31. DOI: 10.1097/NMD.0b013e31816ff3bf.
6. Collop NA, Anderson WM, Boehlecke B, Claman D, Goldberg R, Gottlieb DJ, et al. Clinical Guidelines for the use of unattended portable monitors in the diagnosis of obstructive sleep apnea in adult patients. Portable Monitoring Task Force of the American Academy of Sleep Medicine. J Clin Sleep Med 2007; 3: 737-47. PMID: 18198809.
7. Standard of Practice Committee of the American Sleep Disorders Association. Practice parameters for the use of portable recording in the assessment of obstructive sleep apnoea. Sleep 1994; 139: 559-68. PMID: 7973322.
8. Collop NA, The effect of obstructive sleep apnea on chronic medical disorders. Cleve Clin J Med. 2007 Jan;74(1):72-8. DOI: 10.3949/ ccjm.74.1.72.
9. Trikalinos TA, Ip S, Raman G, Cepeda MS, Balk EM, D'Ambrosio C, et al. Home Diagnosis of Obstructive Sleep Apnea-Hypopnea Syndrome. Rockville (MD): Agency for Healthcare Research and Quality (US); 2007 Aug 8. PMID: 25473717. Bookshelf ID: NBK254138.
10. Report of a Joint Nordic Project. Obstructive sleep apnoea syndrome: a systematic literature review Stockholm: SBU, 2007. PMID: 28876733. Bookshelf ID: NBK447983.
11. Skomro RP, Gjevre J, Reid J, McNab B, Ghosh S, Stiles S, et al. Outcomes of home-based diagnosis and treatment of obstructive sleep apnea. Chest 2010; 138: 257-63. DOI: 10.1378/chest.09-0577.
12. Kuna ST, Gurubhagavatula I, Maislin G, Hin S, Hartwig KC, McCloskey S, et al. Non inferiority of functional outcome in ambulatory management of obstructive sleep apnea. American Journal of Respiratory and Critical Care Medicine 2011; 183: 1238-44. DOI: 10.1164/rccm.201011-1770OC.
13. Engleman HM, Douglas NJ. Sleepiness, cognitive function, and quality of life in obstructive sleep apnoea/ hypopnoea syndrome. Thorax 2004; 59: 618–622. DOI: 10.1136/thx.2003.015867.
14. Johns MW. A new method for measuring daytime sleepiness: the Epworth Sleepiness Scale. Sleep 1991; 14: 540-545. DOI: 10.1093/ sleep/14.6.540.
15. Buysse DJ, Hall ML, Strollo PJ, Kamarck TW, Owens J, Lee L, et al. Relationships between the Pittsburgh Sleep Quality Index (PSQI), Epworth Sleepiness Scale (ESS), and clinical /polysomnographic measures in a community sample. J Clin Sleep Med. 2008 Dec 15;4(6):563-71. PMID: 19110886.
16. Edmundo Rosales-Mayor, Jorge Rey de Castro, Leandro Huayanay. Kenny Zagaceta. Validation and modification of the Epworth Sleepiness Scale in Peruvian population. Sleep Breath (2012) 16:59–69. DOI: 10.1007/s11325-011-0485-1.
17. Rey de Castro J, Rosales-Mayor E, Ferreyra-Pereyra J. Using a generic measure of quality of life in patients with obstructive sleep apnea. Sleep Breath, 2011, 15(4):729-35. DOI: 10.1007/s11325-010-0429- 1.
18. Testa MA, Simonson DC. Assesment of quality-of-life outcomes. N Engl J Med 1996, 334(13):835-40. DOI: 10.1056/ NEJM199603283341306.
19. Flemons WW, Reimer MA. Measurement properties of the Calgary sleep apnea quality of life index. Am J Respir Crit Care Med, 2002, 165(2):159-64. DOI: 10.1164/ajrccm.165.2.2010008.
20. Constantin E, Tewfik TL, Brouillette RT. Can the OSA-18 quality- of-life questionnaire detect obstructive sleep apnea in children? Pediatrics, 2010, 125(1):162-8. DOI: 10.1542/peds.2009-0731.
21. Weaver TE, Laizner AM, Evans LK, Maislin G, Chugh DK, Lyon K, et al. An instrument to measure functional status outcomes for disorders of excessive sleepiness. Sleep 1997; 20(10): 835-843. PMID: 9415942.
22. Vidal S, Ferrer M, Masuet C, Somoza M, Martínez J, Monasterio C. Medida del impacto de los trastornos del sueño: las versiones españolas del cuestionario del impacto funcional del sueño y de la escala de somnolencia de Epworth. Med Clin (Barc). 1999; 113: 250-255. PMID: 10544379.
23. Korpe L, Lundgren J, Dahlström L. Psychometric evaluation of a Swedish version of the Functional Outcomes of Sleep Questionnaire, FOSQ. Acta Odontol Scand. 2013 Sep;71(5):1077-84. DOI: 10.3109/00016357.2012.741708.
24. Flemons WW, Buysee D, Redline S. Sleep-related breathing disorders in adults: recommendations for syndrome definition and measurement techniques in clinical research. The Report of an American Academy of Sleep Medicine Task Force. Sleep 1999; 22 ((5): 667-89. PMID: 10450601.
25. Rodríguez-Pérez V, Valencia-Flores M, Reyes-Lagunes I, Lara-Muñoz M. Adaptación y validación psicométrica del Cuestionario de Consecuencias Funcionales del Dormir (Functional Outcomes Sleep Questionnaire [FOSQ]) en habitantes de la Ciudad de México. Salud Ment. 2013; 4: 307-13. ISSN 0185-3325.
26. Serra-Torres S, Bellot-Arcís C, Montiel-Company JM, Marco-Algarra J, Almerich-Silla JM. Effectiveness of mandibular advancement appliances in treating obstructive sleep apnea syndrome: A systematic review. Laryngoscope. 2016; 126(2): 507–514. DOI: 10.1002/lary.25505.
27. DDurán-Cantolla J, Crovetto-Martínez R, Alkhraisat MH, Crovetto M, Municio A, Kutz R, et al. Efficacy of mandibular advancement device in the treatment of obstructive sleep apnea syndrome: A randomized controlled crossover clinical trial. Med Oral Patol Oral Cir Bucal. 2015; 20(5):605–615. DOI: 10.4317/medoral.20649.
28. Cho JH, Kim HJ. Validation of ApneaLink™ Plus for the diagnosis of sleep apnea. Sleep Breath. 2017; 21(3):799-807. DOI: 10.1007/ s11325-017-1532-3.
29. Letter from FDA approval Intraoral device for snoring and mild to moderate obstructive sleep apnea (OSA), model SomnoMed G2, code: k131240, 2012. (Accessed at https://www.accessdata.fda. gov/cdrh_docs/pdf12/K121340.pdf).
30. Doff MH, Hoekema A, Wijkstra PJ, Van Der Hoeven JH, Huddleston Slater JJ, De Bont LG, et al. Oral appliance versus continuous positive airway pressure in obstructive sleep apnea syndrome: a 2-year follow-up. Sleep. 2013; 36: 1289–96. DOI: 10.5665/sleep.2948.
31. Boyd SB. Walters AS, Waite P, Harding SM, Song Y. Long-Term Effectiveness and Safety of Maxillomandibular Advancement for Treatment of Obstructive Sleep Apnea. Journal of Clinical Sleep Medicine: JCSM: Official Publication of the American Academy of Sleep Medicine, 2015; 11(7): 699–708. DOI: 10.5664/jcsm.4838.
32. Lye KW, Waite PD, Meara D, Wang D. Quality of life evaluation of maxillomandibular advancement surgery for treatment of obstructive sleep apnea. J Oral Maxillofac Surg. 2008; 66: 968–72. DOI: 10.1016/j.joms.2007.11.031.
33. Jurado JC, Jiménez A, Ordóñez I, Roldán B; Chica Galiano MJ, Rueda MT, et al. Efecto del Ejercicio sobre la somnolencia y la calidad de vida en pacientes con apneas del sueño sin indicación de tratamiento con CPAP, Rev Esp Patol Torac. 2015; 27 (4): 201-207.
34. Walker-Engström ML, Wilhelmsson B, Tegelberg A, Dimenäs E, Ringqvist I. Quality of life assessment of treatment with dental appliance or UPPP in patients with mild to moderate obstructive sleep apnoea. A prospective randomized 1-year follow-up study. J Sleep Res. 2000;9(3):303- 8. DOI: 10.1046/j.1365- 2869.2000.00210.x.
35. Levendowski DJ, Morgan TD, Patrickus JE, Westbrook PR, Berka C, Zavora T, et al. In-home evaluation of efficacy and titration of a mandibular advancement device for obstructive sleep apnea. Sleep Breath. 2007;11 (3):139-47. DOI: 10.1007/s11325-006-0094-6.
36. Saletu A, Anderer P, Parapatics S, Matthai C, Matejka M, Saletu B. Effects of a mandibular repositioning appliance on sleep structure, morning behavior and clinical symptomatology in patients with snoring and sleep-disordered breathing. Neuropsychobiology. 2007;55(3-4):184- 93. DOI: 10.1159/000107071.
37. Phillips CL, Grunstein RR, Darendeliler MA, Mihailidou AS, Srinivasan VK, Yee BJ, et al. Health outcomes of continuous positive airway pressure versus oral appliance treatment for obstructive sleep apnea: a randomized controlled trial. Am J Respir Crit Care Med. 2013;187(8):879- 87. DOI: 10.1164/rccm.201212-2223OC.
38. Nussbaumer-Ochsner Y, Schuepfer N, Ulrich S, Bloch KE. Exacerbation of sleep apnoea by frequent central events in patients with the obstructive sleep apnoea syndrome at altitude: a randomised trial. Thorax. 2010;65(5):429-35. DOI: 10.1136/ thx.2009.125849.
39. Esteller-Moré E, Moyano-Montero A, Segarra-Isern F, Amorós- Baixauli F, Matiñó-Soler E, Prades- Morera E, et al. Dispositivos de avance mandibular para el tratamiento de los trastornos respiratorios del sueño del adulto. Acta Otorrinolaringológica Española 61.4 (2010): 293-300. ISSN 0001-6519.
40. Hamoda MM, Almeida FR, Pliska BT. Long-term side effects of sleep apnea treatment with oral appliances: nature, magnitude and predictors of long-term changes. Sleep Med. 2019; 56:184-191. DOI: 10.1016/j.sleep.2018.12.012.
Notas de autor
cesar.chavez.g@upch.pe