Reportes de Casos
Enfermedad gonocócica diseminada: Reporte de caso
Disseminated gonococcal infection: Case report
Enfermedad gonocócica diseminada: Reporte de caso
Acta Médica Peruana, vol. 39, núm. 4, pp. 386-391, 2022
Colegio Médico del Perú

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
Recepción: 21 Julio 2022
Aprobación: 20 Octubre 2022
Resumen: Introducción: La infección por Neisseria gonorrhoeae (NG) es la segunda causa enfermedad de transmisión sexual (ETS), con una incidencia en aumento, altas tasas de resistencia antibiótica y con su mayor presentación a nivel genital. Su presentación con bacteriemia es menor del 3 %, con limitante en su diagnóstico por su bajo rendimiento. Por lo anterior reportamos el caso. Presentación caso: Hombre de 60 años con antecedente de diabetes mellitus, quien ingresa por cuadro poliarticular con sinovitis, asociado a un síndrome febril, sin otro hallazgo al examen físico. Se documenta bacteriemia por NG, con nexo temporal con relación sexual previa. Se indica tratamiento antibiótico según antibiograma con profilaxis a pareja. Paciente egresa sin ninguna complicación. Conclusión: La diseminación hemática por NG es una condición rara, con síntomas iniciales muy inespecíficos, con bajo rendimiento de pruebas diagnósticas en esta condición, por lo cual requiere alta sospecha clínica y cobra gran importancia una historia clínica muy detallada. Como en nuestro caso, los síntomas inespecíficos condicionaron a descartar otras condiciones hasta el aislamiento en hemocultivos lleva a diagnósticos definitivo. Es un caso con presentación clínica inusual.
Palabras clave: Neisseria gonorrhoeae, Gonorrea, Bacteriemia.
Abstract: Introduction: Infection by Neisseria gonorrhoeae (NG) is the second cause of sexually transmitted disease (ETS), with an increasing incidence, high rates of antibiotic resistance and with its greatest presentation at the genital level. Its presentation with bacteriemia is less than 3%, limiting its diagnosis due to its low performance. Therefore, we report the case. Case presentation: 60-year-old man with a history of diabetes mellitus, who was admitted due to polyarticular symptoms with synovitis, associated with a febrile syndrome, with no other finding on physical examination. Bacteremia due to Neisseria gonorrhoeae is documented, with a temporal link with previous sexual intercourse. Antibiotic treatment is indicated according to antibiogram with partner prophylaxis. Patient is discharged without any complications. Conclusion: Hematic dissemination by NG is a rare condition, with very non-specific initial symptoms, with low performance of diagnostic tests in this condition, which requires high clinical suspicion, and a very detailed clinical history is of great importance. As in our case, nonspecific symptoms led to ruling out other conditions until isolation in blood cultures leads to a definitive diagnosis. It is a case with unusual clinical presentation
Keywords: Neisseria gonorrhoeae, Gonorrhea, Bacteriemia.
INTRODUCCIÓN
La infección gonocócica causada por NG, el cual es un diplococo gram negativo no capsulado, aerobio estricto, y un patógeno exclusivamente humano con tropismo por mucosas, afecta principalmente el epitelio columnar de uretra, endocérvix, recto, faringe y conjuntivas [1]. El gonococo fue descubierto por Albert L. Neisser en 1879, al documentar micrococos en descarga purulenta uretral de pacientes tanto hombres como mujeres [2]. Desde sus primeros reportes a la fecha hay un aumento en incidencia, con datos a nivel mundial de alrededor de 87 millones de casos por año, con un 63 % de aumento desde el 2008 hasta el 2018 en Norte América [2,3]. Actualmente es la segunda causa más prevalente de ETS en el mundo, por debajo de la infección por Chlamydia Trachomatis (CT) [1]. Al 2016 se estima una incidencia de 20/1000 en mujeres y 26/1000 en hombres, con reporte de 700 000 casos anuales en Estados Unidos [4].
La principal manifestación es a nivel genital, incluye cervicitis y enfermedad pélvica inflamatoria en mujeres, uretritis y epididimitis en hombres. Los síntomas extra genitales más comunes son faringitis, proctitis y conjuntivitis, y su presentación depende del grado de inoculación del agente [5]. La infección gonocócica diseminada es una condición de rara presentación, reportada solo en el 0,5 % al 3 %, con el principal hallazgo clínico del compromiso en piel (40 % de los casos) [3,6], se presenta más en mujeres, en periodo de menstruación, tercio final del embarazo, compromiso faríngeo de la infección, resistencia antibiótica y deficiencias de complemento [1,5]. Cuando se presenta una bacteriemia por NG debe pasar la gran limitante que es su aislamiento ya que solo se encuentran positivo los hemocultivos en menos del 10 %, siendo sujeto su aislamiento al estadio de la enfermedad y la presencia o no del aditivo anticoagulante usado en hemocultivos que limita el crecimiento de las especies de Neisseria [5,7]. Reportamos el caso de un hombre con único antecedente de diabetes mellitus, quien en contexto de un síndrome febril con afectación poliarticular mimetiza inicialmente otras patologías con posterior documentación de bacteriemia por NG, una presentación inusual por lo cual aportamos con reporte de caso y revisión de la literatura.
PRESENTACIÓN DE CASO
Hombre de 60 años con historia médica de diabetes mellitus tipo 2, controlado en manejo con metformina 850 mg día (Hemoglobina glicosilada: 7% 1 mes previo a ingreso), sin referir otro antecedente. Consulta por cuadro clínico de 15 días de evolución consistente en dolor poliarticular y polisinovitis, asociado a rigidez matutina con duración de 20 minutos aproximadamente, astenia, adinamia, hiporexia y sensación de distermias en los últimos 4 días; automedicado con naproxeno 250 mg cada 8 horas por 3 días previo ingreso sin mejoría por lo cual consulta. Al examen físico de ingreso presión arterial 130/76 mmhg, frecuencia cardiaca de 76 LPM, saturando 94 % al ambiente, con único hallazgo al examen físico de sinovitis con edema, calor, rubor y dolor a la palpación a nivel de articulaciones metacarpofalángicas bilateral, muñecas, rodilla derecha y tobillos (Ver imagen 1), sin compromiso de mucosas, piel o zona genital, con ecografía articular no susceptible de drenaje para estudio de líquido sinovial.
Los paraclínicos iniciales muestran leucocitosis con neutrofilia y PCR (Proteína C reactiva) elevada, resto de límites normales (Ver tabla 1). Se amplían estudios con perfil infeccioso, metabólico y autoinmune dentro de límites normales excepto por un factor reumatoide positivo; radiografía de tórax dentro de límites normales y radiografía de manos sin alteraciones óseas con edema de tejidos blandos (Ver imagen 2). El rastreo microbiológico solicitado al ingreso da preliminar a las 29,7 horas de morfología indeterminada, con cubrimiento antibiótico empírico con ampicilina sulbactam a dosis de 3 gramos cada 6 horas.
Se hace tipificación completa en su quinto día de hospitalización con aislamiento de NG en dos de los tres hemocultivos susceptible a cefalosporinas de tercera generación y quinolonas. Durante los días de observación el paciente persiste febril, sin patrón específico en el día sin deterioro clínico. Se realiza un nuevo interrogatorio al paciente debido a aislamiento, manifestó que presentó relaciones sexuales sin uso de condón aproximadamente 15 días antes del inicio del cuadro. Se realizó tamizaje de compromiso orgánico con ecocardiograma sin alteraciones y valoración por oftalmología dentro de límites normales
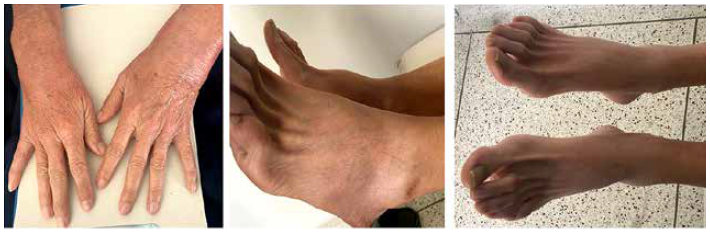
Imagen 1.
Se observa compromiso poliarticular en enfermedad gonocócica diseminada A Compromiso con sinovitis en metacarpofalángicas y muñeca B y C Compromiso de sinovitis con edema en tobillos
Se indica manejo con ceftriaxona intravenosa 1 gramo día por 7 días más azitromicina 1 gramo dosis única. En su seguimiento presenta remisión parcial de componente articular con disminución de reactantes de fase aguda. Se logra contacto con pareja sexual con manejo con cefixime 800 mg oral dosis única y doxicilina 100 mg cada 12 horas por 7 días, lo anterior ante no tener prueba para descartar infección por clamidias. Durante el seguimiento se logra remisión completa de sinovitis y dolor articular.
DISCUSIÓN
La infección por NG es un germen de interés al tener una incidencia en aumento en países en vías de desarrollo, secuelas posterior a la infección, ser una condición tratable, alto riesgo de coinfección y su gran incremento en tasas de resistencia antibiótica [8]. Es la segunda causa de enfermedad de transmisión sexual, seguido de la infección por CT, con un comportamiento de la incidencia en aumento, observando reportes de 700 000 casos por año hasta 1 568 000 por año en Estado Unidos, incluso esto sujeto al subregistro debido al gran número de pacientes que tienen un curso asintomático [9]. Los datos en Latinoamérica muestran una incidencia de 0,57 % en mujeres y 0,68 % en hombres, con prevalencias en estudios de 0,08 a 2,6 %, ubicado en número de casos después de África, datos sujetos a variación por regiones, incluso hasta por nivel socioeconómico [10,11]. El incremento de la resistencia antibiótica ha ubicado a la NG como un germen de prioridad alta para el desarrollo de nuevos antibióticos [12], apoyado en datos de resistencia en Latinoamérica a ciprofloxacina (82,3 %), tetraciclina (hasta 67,3 %), Penicilina (51 %), azitromicina (15,6 %) y ceftriaxona (4,2 %). Esto sumado a que muchos de estos medicamentos, según estudios, se logran conseguir sin receta en 51 % de los países de las Américas [10,13,14].
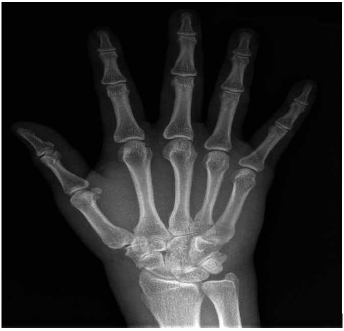
Imagen 2.
Radiografía de mano derecha No lesiones óseas ni articulares se observa edema de tejidos blandos a nivel de metacarpofalángicas
Usualmente este microorganismo suele infectar las superficies mucosas, sin embargo, en menos de 3 % de los casos alcanza diseminación hemática de un foco primario genital, con secuelas que van desde artritis infecciosa, exantema, endocarditis, perihepatitis (síndrome de Fitz-Hugh-Curtis) y meningitis. Dentro del espectro clínico inicial para sospechar la infección por NG están la combinación de poliartralgias, sinovitis y lesiones en piel [15–17]. El periodo de incubación es de 1 a 14 días, con diseminación hemática entre 2 a 3 semanas posterior al inóculo inicial, con datos de incidencia de diseminación de microrganismo no exactos debido al subdiagnóstico, porcentaje alto de asintomáticos y variabilidad de rendimiento en pruebas diagnósticas [18,19]. Dentro de las herramientas diagnósticas contamos con: Tinción de gram o azul de metileno (sensibilidad mayor 95 % para detección de uretritis), cultivo en agar Thayer-Martin, Martin-Lewis o medio New York City (Gold estándar, que requiere incubación de 24 a 72 horas a una temperatura de 35-37°C y con una atmósfera al 5 % de CO2), tipificación con patrones de hidrato de carbono, (MALDI-TOF), hemocultivos (rendimiento menor al 50 % con dosis bajas de el aditivo del anticoagulante polianetol sulfonato de sodio no superior al 0,025 % y menor al 10 % con dosis altas del mismo) y amplificación de ácidos nucleicos (Altos falsos positivos y no aprobado para líquido sinovial o sangre, útil para seguimiento de curación del tratamiento) [1,5].
| Bioquímica general y reactantes de fase aguda | ||
| Paraclínicos | Resultado | Referencia |
| Leucocitos | 24.460/mm3 | 5000 -10000 /mm3 |
| Neutrófilos | 21.770/mm3 | 1800 -7700/mm3 |
| Hemoglobina | 12.8 g/dL | 13 -16 g/dL |
| Hematocrito | 37,2% | 38-50% |
| Plaquetas | 308.000/mm3 | 150.000 400.000 /mm3 |
| VSG | 97,0 mm/h | 22 mm/h |
| Factor reumatoideo | 17,30 IU/mL | < 15 IU/mL |
| Glucosa | 119,5 mg/dL | 70 – 100 mg/dL |
| PCR | 293,2 mg/DL | <1 mg/L |
| Ácido úrico | 2,3 mg/dL | 3,5 – 7,2 mg/dL |
| Sodio | 135,0 mEq/L | 135 – 145 mEq/L |
| Potasio | 4,14 mEq/L | 3.5 – 5 mEq/L |
| Cloro | 100,2 mEq/L | 96- 106 mEq/L |
| Creatinina | 0,76 mg/dL | 0,7 -1 mg/dL |
| Nitrógeno ureico | 41,6 mg/dL | 6- 20 mg/dL |
| ALT | 34,4 U/L | <37 U/L |
| AST | 27,3 U/L | <41 U/L |
| Bilirrubina total | 0,6 mg/dL | 0,2 -1 mg/dL |
| Bilirrubina directa | 0,28 mg/dL | |
| TSH | 3,5 mUI/mL | 0,37 -4,7 mUI/mL |
| T4 libre | 1,26 ng/dL | |
| Perfil de autoinmunidad | ||
| Paraclínico | Resultado (valor de referencia) | |
| Complemento C3 | 1,21 g/L (0,9-1,8) | |
| Complemento C4 | 0,15 g/L (0,1-0,4) | |
| Anticoagulante lúpico | Negativo | |
| Anti la ssb | Negativo | |
| Anti ro ssa | Negativo | |
| Anticuerpos anti rnp | Negativo | |
| Anticuerpos anti-Smith | Negativo | |
| Anticuerpos DNA (IFI) | Negativo | |
| Anticuerpos antinucleares | Negativo | |
| Anticuerpos anticitrulínicos | Negativo | |
| ANCA P y C (IFI) | Negativo | |
| Perfil infeccioso | ||
| Paraclínico | Resultado | |
| ASTOS | Menor de 20 UI/mL (negativo) | |
| CMV IgM | 0,22 negativo | |
| Epstein barr IgG | 102,9 UA/mL positivo | |
| Epstein barr IgM | 0,01 UA/mL negativo | |
| Antígenos febriles | Negativo | |
| VIH 1 y 2 anticuerpos | Negativo | |
| Hepatitis B antígeno E | Negativo | |
| Hepatitis B antígeno de superficie | Negativo | |
| Hepatitis B anticore IgM | Negativo | |
| Prueba no treponémica RPR | No reactivo | |
| Prueba treponémica | Negativo | |
La probabilidad de invasión de tejidos por fuera de la infección localizada depende de factores relacionados con el hospedero, microorganismo y mecanismos inmunológicos. Se sospecha que la infección asintomática aumenta el riesgo de diseminación debido a un diagnóstico y tratamiento tardíos [20]. Las deficiencias congénitas o adquiridas de complemento (C5, C6, C7 o C8) o uso de eculilzumab predisponen a una infección diseminada [21,22]. Aunque el microorganismo carece de cápsula de lipopolisacárido para protegerse de lisis mediado por opsonofagocitosis mediado por complemento, se ha documentado genes codificadores de hidrolasas de peptidoglicano y proteínas de factor F de conjugación que le permite incremento de citotoxicidad de peptidoglicano y transformación DNA natural respectivamente, lo anterior confiriéndole mecanismos de resistencia [2].
No existen ensayos clínicos ni evidencia en cuanto al régimen antimicrobiano ideal en esta entidad. El manejo y la duración del tratamiento se extrapolan de infección no complicada y según opinión de expertos. El tratamiento ideal se debe guiar de acuerdo con condición clínica del paciente y la susceptibilidad del microorganismo evidenciado en el antibiograma. La ceftriaxona intravenosa es el antibiótico de elección inicial en enfermedad diseminada con duración de 7 a 14 días y con adición de manejo empírico de azitromicina dosis única para tratar concomitantemente la infección por CT, ya que existe coinfección en pacientes infectados por NG hasta en un 40,9 % [9]. Se enfatiza en la importancia del uso racional de antimicrobianos, teniendo en cuenta que este microorganismo se ha convertido en un problema de salud pública por su resistencia a antibióticos incluyendo la penicilina, tetraciclinas, sulfonamidas, macrólidos y quinolonas, llegando a ser resistente a cefalosporinas de tercera generación [1,8,11,28].
En conclusión, el caso reportado es una entidad en la literatura de baja prevalencia, en un paciente sin una clara predisposición, con síntomas iniciales inespecíficos, quien a pesar del bajo rendimiento de los hemocultivos logra dar el diagnóstico. Aportamos a la literatura nuestra experiencia con el paciente y su buen desenlace clínico.
Abreviación
NG: Neisseria gonorrhoeae
ETS: Enfermedad de transmisión sexual
CT: Chlamydia Trachomatis
Mg: Miligramos
LPM: Latidos por minuto
REFERENCIAS
1. Barberá MJ, Serra-Pladevall J. Gonococcal infection: An unresolved problem. Enferm Infecc Microbiol Clin [Internet]. 2019;37(7):458–66. Available from: https://doi.org/10.1016/j.eimc.2018.12.008.
2. Humbert MV, Christodoulides M. Atypical, Yet Not Infrequent, Infections with Neisseria Species. Pathogens. 2019 Dec 20;9(1):10. doi: 10.3390/pathogens9010010.
3. Douedi S, Dattadeen J, Akoluk A, Liu E. Disseminated Neisseria gonorrhea of the wrist. IDCases. 2020 Apr 23; 20:e00763. doi: 10.1016/j.idcr.2020.e00763.
4. Rowley J, Vander Hoorn S, Korenromp E, Low N, Unemo M, Abu- Raddad LJ, Chico RM, Smolak A, Newman L, Gottlieb S, Thwin SS, Broutet N, Taylor MM. Chlamydia, gonorrhoea, trichomoniasis and syphilis: global prevalence and incidence estimates, 2016. Bull World Health Organ. 2019 Aug 1; 97(8):548-562P. doi: 10.2471/ BLT.18.228486. ea, trichomoniasis and syphilis. Bull World Health Organ. 2019;97(8):548–62.
5. Burns JE, Graf EH. Closing the Brief Case: Disseminated Neisseria gonorrhoeae in an 18-Year-Old Female. J Clin Microbiol. 2018 Mar 26; 56 (4):e00933-17. doi: 10.1128/JCM.00933-17.
6. Estrada J, Sergent S, Ashurst J. Disseminated Gonorrhea. Clin Pract Cases Emerg Med. 2019 Nov 19; 4(1):83-4. doi: 10.5811/ cpcem.2019.9.44272.
7. Reimer LG, Wilson ML, Weinstein MP. Update on detection of bacteremia and fungemia. Clin Microbiol Rev. 1997 Jul;10(3):444- 65. doi: 10.1128/CMR.10.3.444.
8. Tapsall JW. Neisseria gonorrhoeae and emerging resistance to extended spectrum cephalosporins. Curr Opin Infect Dis. 2009 Feb; 22(1):87-91. doi: 10.1097/QCO.0b013e328320a836.
9. Workowski KA, Bachmann LH, Chan PA, Johnston CM, Muzny CA, Park I, Reno H, Zenilman JM, Bolan GA. Sexually Transmitted Infections Treatment Guidelines, 2021. MMWR Recomm Rep. 2021 Jul 23;70(4):1-187. doi: 10.15585/mmwr.rr7004a1.
10. Paredes MC, Gómez YM, Torres AM, Fernández M, Tovar MB. Prevalencia de infecciones por Chlamydia trachomatis y Neisseria gonorrhoeae en adolescentes de colegios de la provincia de Sabana Centro, Cundinamarca, Colombia [Prevalence of infections by Chlamydia trachomatis and Neisseria gonorrhoeae among high school students in the Sabana Central area of Cundinamarca, Colombia]. Biomedica. 2015 Jul-Sep;35(3):314-24. Spanish. doi: 10.7705/biomedica.v35i3.2398.
11. Rivillas-García JC, Sanchez SM, Rivera-Montero D. Desigualdades sociales relacionadas con la resistencia a antimicrobianos de N. gonorrhoeae en Colombia. Rev Panam Salud Pública. 2020;44:1. DOI https://doi.org/10.26633/RPSP.2020.4
12. ORIENTACIÓN UNIFICADA VIGILANCIA DE LA RESISTENCIA A LOS ANTIMICROBIANOS DE NEISSERIA GONORRHOEAE. PAHO Iris https://doi.org/10.37774/9789275322369.
13. Worldwide country situation analysis: response to antimicrobial resistance. 2015 [cited 2022 Mar 15]; Available from: http://www. who.int/drugresistance/en/ISBN9789241564946.
14. Jorge-Berrocal A, Mayta-Barrios M, Fiestas-Solórzano V. ANTIMICROBIAL RESISTANCE OF Neisseria gonorrhoeae IN PERU. Rev Peru Med Exp Salud Publica [Internet]. 2018 [cited 2022 Mar 15];35(1):155–61. DOI: https://doi.org/10.17843/ rpmesp.2018.351.3552.
15. Dillard JP, Seifert HS. A variable genetic island specific for Neisseria gonorrhoeae is involved in providing DNA for natural transformation and is found more often in disseminated infection isolates. Mol Microbiol. 2001;41(1):263–77. doi: 10.1046/j.1365- 2958.2001.02520.x.
16. Akkinepally S, Douglass E, Moreno A. Tricuspid valve gonococcal endocarditis: Fourth case report. Int J Infect Dis. 2010 Sep; 14 Suppl 3:e196-7. doi: 10.1016/j.ijid.2009.07.010.
17. Beatrous SV, Grisoli SB, Riahi RR, Matherne RJ, Matherne RJ. Cutaneous manifestations of disseminated gonococcemia. Dermatol Online J. 2017 Jan 15; 23(1):13030/qt33b24006. 18. DOI: https://doi.org/10.5070/D3231033674.
18. Lee MH, Byun J, Jung M, Yang JJ, Park KH, Moon SY, Lee HJ, Lee MS. Disseminated gonococcal infection presenting as bacteremia and liver abscesses in a healthy adult. Infect Chemother. 2015 Mar;47(1):60-3. doi: 10.3947/ic.2015.47.1.60.
19. Label A, Tirelli LL, Luna PC, et al. Disseminated gonococcal infection: another great simulator. Med Cutan Iber Lat Am. 2020; 48(1):75-79. doi:10.35366/93982.
20. Barbee LA, Soge OO, Katz DA, Dombrowski JC, Holmes KK, Golden MR. Increases in Neisseria gonorrhoeae With Reduced Susceptibility to Azithromycin Among Men Who Have Sex With Men in Seattle, King County, Washington, 2012-2016. Clin Infect Dis. 2018 Feb 10;66(5):712-718. doi: 10.1093/cid/cix898.
21. Katyal N, Nirola L, Narula N, Govindarajan R. Diffuse Gonococcal Infection (DGI) in a Patient with Treatment-Refractory Acetylcholine Receptor Antibody-Positive (AChR+) Generalized Myasthenia Gravis (gMG) Treated with Eculizumab. Case Rep Neurol Med. 2021 Jun 14; 2021: 9713413. doi: 10.1155/2021/9713413.
22. Mitchell SR, Nguyen PQ, Katz P. Increased risk of neisserial infections in systemic lupus erythematosus. Semin Arthritis Rheum. 1990 Dec; 20(3):174-84. doi: 10.1016/0049-0172(90)90058-n.
23. Zeth K, Kozjak-Pavlovic V, Faulstich M, Fraunholz M, Hurwitz R, Kepp O, Rudel T. Structure and function of the PorB porin from disseminating Neisseria gonorrhoeae. Biochem J. 2013 Feb 1; 449(3):631-42. doi: 10.1042/BJ20121025.
24. Rechner C, Kühlewein C, Müller A, Schild H, Rudel T. Host glycoprotein Gp96 and scavenger receptor SREC interact with PorB of disseminating Neisseria gonorrhoeae in an epithelial invasion pathway. Cell Host Microbe. 2007 Dec 13;2(6):393-403. doi: 10.1016/j.chom.2007.11.002.
25. Gutjahr TS, Rourke MO, Catherine A, Spratt BG. Ni Ne-, Hypoxant Hine-, Uraci Llrequi Ring Isolates of. 1997;(1 997):633–40.
26. Roth A, Mattheis C, Muenzner P, Unemo M, Hauck CR. Innate recognition by neutrophil granulocytes differs between Neisseria gonorrhoeae strains causing local or disseminating infections. Infect Immun. 2013 Jul; 81(7):2358-70. doi: 10.1128/IAI.00128-13.
27. Faulstich M, Böttcher JP, Meyer TF, Fraunholz M, Rudel T. Pilus phase variation switches gonococcal adherence to invasion by caveolin-1- dependent host cell signaling. PLoS Pathog. 2013;9(5):e1003373. doi: 10.1371/journal.ppat.1003373.
28. Derbie A, Mekonnen D, Woldeamanuel Y, Abebe T. Azithromycin resistant gonococci: a literature review. Antimicrob Resist Infect Control. 2020 Aug 18;9(1):138. doi: 10.1186/s13756-020-00805-7.
Notas de autor
carlosm.martinez@urosario.edu.co