Reportes de Casos
Gangrena vesicular por colecistitis hemorrágica en paciente sin factores de riesgo: reporte de un caso
Gallbladder gangrene due to hemorrhagic cholecystitis in a patient without risk factors: a case report
Gangrena vesicular por colecistitis hemorrágica en paciente sin factores de riesgo: reporte de un caso
Acta Médica Peruana, vol. 39, núm. 3, pp. 304-310, 2022
Colegio Médico del Perú

Esta obra está bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional.
Recepción: 15 Marzo 2022
Aprobación: 04 Agosto 2022
Resumen:
La colecistitis hemorrágica es una complicación rara de la colecistitis aguda, pero con alta mortalidad. Clínicamente es idéntica a la colecistitis aguda, y no suele presentarse con hemorragia gastrointestinal. Presentamos el caso de un varón 57 años, sin antecedentes, ni uso de anticoagulantes, referido a nuestro hospital por una “tumoración vesicular”, tras los estudios tomográficos y de colangioresonancia, asociado a la caída de hemoglobina sérica, se define su sospecha. Ingresa a sala de operaciones y se evidencia una vesícula gangrenada, conteniendo coágulos y cálculos. Confirmando su diagnóstico con el estudio histopatológico. Debido a su similitud clínica, debe considerarse en pacientes con antecedentes de terapia anticoagulante, trauma, malignidad, o hallazgos compatibles con colecistitis alitiásica. Pero puede presentarse en pacientes sin antecedentes y estar asociado a colelitiasis. El diagnóstico temprano de esta complicación potencialmente fatal es importante para facilitar el manejo quirúrgico urgente, siendo el apoyo imagenológico, necesario para su sospecha.
Palabras clave: Colecistitis Aguda, Vesícula Biliar, Hemobilia.
Abstract:
Hemorrhagic cholecystitis is a rare complication of acute cholecystitis, but with high mortality. Clinically it is identical to acute cholecystitis, and it does not usually present with gastrointestinal bleeding. We present the case of a 57-year-old man, with no history or use of anticoagulants, referred to our hospital for a "gallbladder tumor", after tomographic and cholangioresonance studies, associated with a drop in serum hemoglobin, suspicion of him is defined. He enters the operating room and a gangrenous gallbladder is evident, containing clots and stones. Confirming his diagnosis with histopathological study. Due to its clinical similarity, it should be considered in patients with a history of anticoagulant therapy, trauma, malignancy, or findings consistent with acalculous cholecystitis. But it can occur in patients with no history and be associated with cholelithiasis. Early diagnosis of this potentially fatal complication is important to facilitate urgent surgical management, imaging support being necessary for its suspicion.
Keywords: Cholecystitis Acute, Gallbladder, Hemobilia.
INTRODUCCIÓN
La colecistitis hemorrágica (CH) es una complicación rara de la colecistitis aguda (CA) [1–6] ya sea o no asociada a cálculos biliares [7]. Se define como la hemorragia en el interior de la vesícula biliar (VB) causada por infarto y erosión de la mucosa debido a la inflamación transmural de la pared vesicular [6,7]. También, se utiliza para describir hemorragia intraluminal [7,8] o peritoneal secundaria a CA [7].
La CH puede estar enmascarada por otros procesos en pacientes con múltiples comorbilidades médicas, en particular aquellos que están críticamente enfermos [2] o usan anticoagulantes [9]. Y se debe considerar cuando se encuentran presentaciones inusuales de colecistitis [5,9]. Un retraso en el diagnóstico puede provocar una hemorragia grave y la necesidad de una intervención quirúrgica urgente [2]. La hemobilia (HB) en cambio, es la presencia de sangre en o a través del tracto biliar [10,11].
La incidencia de CA grave es del 6 %, de éste, solo el 8-12 % desarrollan CH [6,7]. Mientras que la CH con perforación de la VB y hemorragia masiva es aún menos frecuente, con una incidencia de 2-11 % [6,7], y una mortalidad por arriba del 70 % [6].
La CH puede ocurrir por: colecistitis obstructiva (50 %), traumatismos contusos, intervenciones percutáneas, neoplasias biliares, parásitos biliares, anticoagulación, hemorragias espontáneas en pacientes con insuficiencia renal y cirrosis, y el angiosarcoma [1,4,8,12–17]. En particular, las neoplasias gastrointestinales (cáncer VB y el cáncer metastásico), y el uso de aspirina; pueden causar CH [7]. Además, puede estar causada, por la formación de pseudoaneurisma de la arteria cística con posterior ruptura y hemorragia franca en la VB siendo ésta causa de una alta mortalidad [7].
La CH es una enfermedad rara con un amplio espectro de presentaciones potenciales [3,9]. Los síntomas imitan la colecistitis litiásica, por lo que puede pasarse por alto fácilmente, e incluyen dolor en el cuadrante superior derecho (CSD), signo de Murphy positivo, fiebre y leucocitosis [6,7,12,13,18,19], puede incluir hemobilia, o hematemesis, ictericia y melena [3,6,12]. El coágulo de la VB también puede causar obstrucción del conducto biliar común y colangitis [12].
El diagnóstico al igual que con cualquier patología de la VB, debe comenzar con la historia clínica, el examen físico, los análisis de laboratorio y las imágenes [9] e investigar sobre el uso de anticoagulantes [13].
El ultrasonido abdominal es el primer método diagnóstico en pacientes con dolor CSD, sin embargo, en el caso de CH no hay ningún signo absolutamente patognomónico resultando muy engañoso [6,7]. Además, debido a su ecogenicidad similar, los coágulos pueden enmascararse como cálculos biliares en los estudios de imágenes [11]. Por lo que la tomografía computarizada (TC) abdominal con contraste es crucial en el diagnóstico rápido y preciso [6,7], ya que puede mostrar el sitio de la perforación de la VB y el hemoperitoneo [6,7], mostrando extravasación de contraste, alta atenuación dentro de la luz de la VB y capas de contenido líquido heterogéneo [9]; o una VB distendida y materiales heterogéneos en el interior [1,17].
Debido a que conlleva una alta tasa de morbilidad y mortalidad, particularmente cuando se complica por perforación, necrosis o hemorragia potencialmente masiva [5,7,18]; el tratamiento consiste en una colecistectomía urgente [5,7].
En la literatura se han descrito muy pocos casos de CH [1,2,6,7,9,10,17,19,20] y ninguno en nuestro medio. Por lo que presentamos un caso de CH que se manifestó como un cuadro de CA complicada, en un paciente varón sin antecedentes patológicos.
REPORTE DE CASO
Presentamos el caso de un varón de 57 años, con antecedente de TBC pulmonar hace 20 años. Que hace 2 días presentó dolor en CSD, con irradiación a zona lumbar ipsilateral, asociado a náuseas y vómitos, y orinas oscuras. Por lo que acude a hospital, donde le realizan una ecografía abdominal, informada como VB con formación tumoral (Figura 1A), siendo referido a nuestro hospital. A su ingreso por emergencia, persistía el dolor en CSD a pesar de medicación analgésica. Al examen, paciente hemodinámicamente estable, dolor y masa palpable en CSD, y signo de Murphy positivo. La analítica de ingreso mostró una hemoblogina 14.0(VN:12-16gr/dl), hemograma 13000(VN: 5000-10000/mm3), INR 1.17, Bilirrubina total de 7.06 (a predominio directo 1.45) (VN:0.2-1.2mg/dl), fosfatasa alcalina(FA): 170(VN:27-100U/L), Gama-glutamil transferasa (GGTP): 409(VN:12-45U/L), amilasa en 66(VN: 0-120U/L), TGO 850(VN:<45U/L), TGP 980(VN:<45U/L). La ecografía fue informada como signos de CA litiásica con contenido biliar denso (Figura 1B). Se realizó una TC abdominal informada como CA litiásica con cambios inflamatorios perivesiculares y contenido hiperdenso, a considerar barro biliar o hemorragia (Figura 2A, 2B y 2C). Los marcadores tumorales (CA 125, AFP, CA19.9, CEA) y serológicos resultaron negativos; y los controles de hemoglobina y bilirrubinas disminuyeron de 14 a 12gr/dl y 7.06 a 0.66 respectivamente; además gastroenterología descartó proceso tumoral ampular. Finalmente, la colangioresonancia concluyó signos de CA litiásica con bilis de señal hemática (Figura 2D,2E y 2F). Por lo que se decide su intervención quirúrgica, realizándose una colecistectomía laparoscópica, donde se evidenció adherencias de epiplón, colon transverso, duodeno y VB, una VB gangrenada en cuerpo y bacinete conteniendo coágulos rojo oscuro y múltiples litiasis (Figura 3). Paciente cursa con buena evolución, recibiendo antibióticoterapia y tres dosis de ácido tranexámico. Tolera dieta oral a las 8 horas de la cirugía, y dieta blanda a las 24 horas, y es dado de alta a los 2 días, tolerando dieta y sin drenajes. El estudio histopatológico reveló áreas de hemorragia, necrosis e infiltrado inflamatorio agudo, confirmando el diagnóstico (Figura 4).
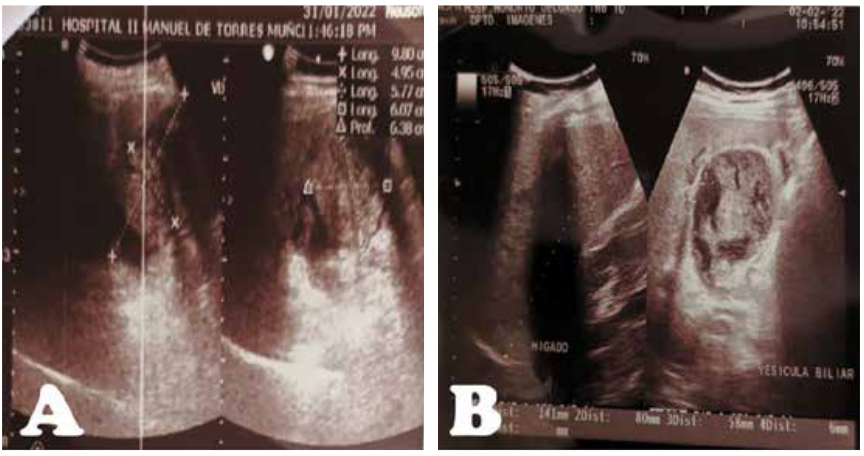
Figura 1.
A, Ecografía abdominal del hospital de Mollendo: Vesícula de 9.8x4.9cm de paredes delgadas con contenido líquido, con presencia de “formación tumoral de 5x6cm de ecoestructura heterogénea con dos imágenes hiperecogénicas en su interior”. B, Ecografía abdominal en nuestra institución: Vesícula biliar distendida de 80x58mm, de paredes engrosadas de 6mm, con imágenes isodensas en su interior, al parecer no dependientes de pared, si flujo doppler, sugerente de contenido biliar denso, con imagen litiásica en su interior de 14mm.
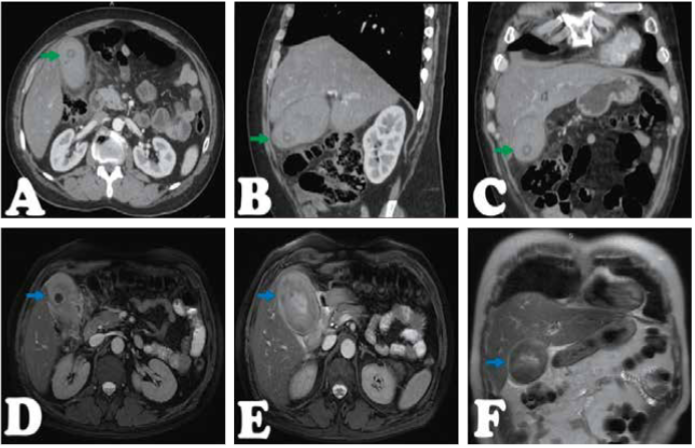
Figura 2.
Tomografía abdominal con contraste. Vesícula distendida de 106x60mm paredes al parecer gruesas (poco definibles) contenido hiperdenso >60UH, que con el contraste varía muy poco, presenta litiasis internas con densidades mixtas y cambios inflamatorios periféricos. Flecha verde, A, Corte transversal. B, Corte sagital. C, Corte coronal. Colangioresonancia con contraste. Vesícula distendida de 98x59mm paredes engrosadas e irregulares, contenido de señal baja(hipointensa) heterogénea en T2, alta heterogénea en FIESTA, que contiene litiasis en el fondo de 15mm, y finas colecciones perivesiculares. Flecha azul, D y E, Corte transversal. F, Corte coronal.
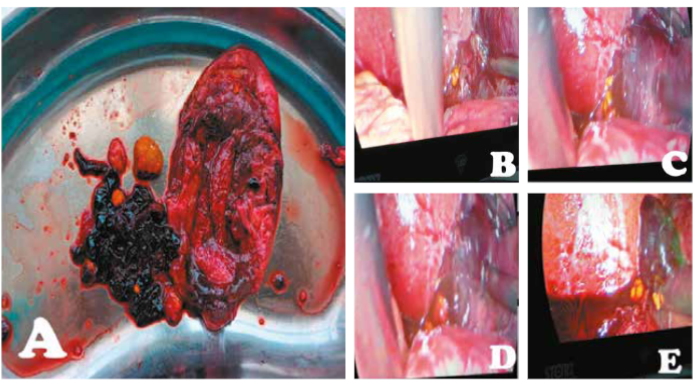
Figura 3.
Hallazgos intra-operatorios. A, Vesícula distendida de 15x8x6cm gangrenada en cuerpo y bacinete, conteniendo en su interior coágulos organizados color rojo oscuro, y múltiples cálculos, el mayor de 15mm. B,C,D y E, Salida de contenido vesicular (coágulos y cálculos) durante la colecistectomía laparoscópica
DISCUSIÓN
La CA es una de las consecuencias más comunes de colelitiasis, que ocurre principalmente debido a la obstrucción del conducto cístico por cálculos impactados [21,22]. El desarrollo de cambios secundarios en el contexto de la CA, como gangrena, inflamación xantogranulomatosa, hemorragia y enfisema, define la CA grave [21,23]. Al mismo tiempo, la CA grave o severa, se asocia con un riesgo considerable de daño a las estructuras colaterales como la arteria hepática y el árbol biliar; así como altas tasas de conversión de cirugía laparoscópica a cirugía abierta [21,24] y mayor tasa de morbilidad y mortalidad [23,24].
La colecistitis gangrenosa (CG) o gangrena vesicular, es la complicación más común de la CA [25]. La misma, surge de la CA, en presencia de signos histológicos de inflamación transmural y necrosis isquémica de la pared de la VB [23]. Un cálculo biliar que obstruye el conducto cístico, produce colestasis e impide el flujo de sangre de la pared vesicular como resultado de la opresión de la pared de la VB debido a una presión biliar interna elevada [26], lo que induce isquemia y conversión a tejido necrótico [25]. La incidencia de CG en pacientes que presentan CA oscila entre el 19-40 % [21,24], en promedio el 30 % de ellos pueden convertirse a CG [25]; y el factor de riesgo más prevalente es la diabetes mellitus, la cual se asocia a poli-neuropatía, lo cual puede enmascarar el cuadro [22,25].
La CH, en cambio, es una complicación rara de CA, asociada o no a cálculos biliares [7], pero por lo general asociada a colelitiasis (50 %) [1,4,8,14,16]. Es una progresión única de la CA típica, cuando no se trata, en pacientes susceptibles[2]; considerada como la etapa final de la colelitiasis [3], antes de la CG [15]. Siendo los cambios ateroscleróticos en la pared de la VB, el factor predisponente más común [16].
La CH se considera una emergencia, debido a que conlleva una alta morbilidad y mortalidad (15-20 %) [1,2,6,7,18], y especialmente cuando se complica con perforación de la VB y hemorragia masiva [1,2,6].
La inflamación transmural de la pared provoca erosión de la pared, hemorragia, cambios isquémicos posteriores como erosión de la mucosa y necrosis mural [1,4]; con eventual daño vascular (destrucción de las paredes de los vasos o formación de pseudoaneurisma de la arteria cística); todo ello, puede provocar una hemorragia en la luz [1–3,15,18], la formación de un hematoma, perforación y hemoperitoneo [4,7]. Distinto de otras formas de necrosis de la VB secundaria a colecistitis [2]. Además, los cálculos biliares pueden causar daño directo de la mucosa del conducto biliar y erosionar el vaso (arteria cística), lo que resulta en una hemorragia intraductal leve que puede coagularse y causar obstrucción [10]. Al mismo tiempo, dichas las úlceras mucosas causadas no sanarán mientras se esté consumiendo anticoagulantes [13].
Los síntomas varían desde un dolor abdominal vago hasta una hemorragia catastrófica [2]. La presentación clínica puede ser indistinguible de la CA no complicada [18], con dolor abdominal (síntoma predominante) [14], leucocitosis y fiebre [13,14,18].
El cólico biliar, la hematemesis, la ictericia y la melena son inusuales pero clásicos [3,12,15,18]. Otras presentaciones incluyen hemorragia gastrointestinal superior, hidropesía de la VB, hemoperitoneo u obstrucción del colédoco [27].
La perforación es menos común, pero está asociada a una alta mortalidad (30 %), caracterizada por un alivio transitorio del dolor abdominal, seguido de signos peritoneales [18]. Puede manifestarse como un cuadro agudo, con la salida de bilis a cavidad peritoneal (tipo I); o cuadro subagudo produciendo un absceso perivesicular (tipo II); o un proceso crónico con la formación de una fístula colecistoentérica o colecistocutánea (tipo III) [7]. El fondo de la VB es el sitio más frecuente de perforación debido a su escasa vascularización [4,7]. Existe mayor riesgo en el sexo masculino, la edad avanzada, la enfermedad sistémica y el uso crónico de corticosteroides [4].
Los hallazgos del examen bioquímico pueden no diferenciarse de una CA típica [15]. En caso de hemorragia, se puede observar una caída de la hemoglobina e hipotensión [4]; y un patrón colestásico puede representar un coágulo en el árbol biliar [15].
Nuestro caso trató de un varón [2,3,6,9,16,18,19,28], sin antecedentes patológicos [5,17]. Sin historia de neoplasias, [12] lupus [20], hipertensión [6,8,18,19,28,29], consumo de anticoagulantes, antiagregantes [2,9,18,19,30], corticoides [20].
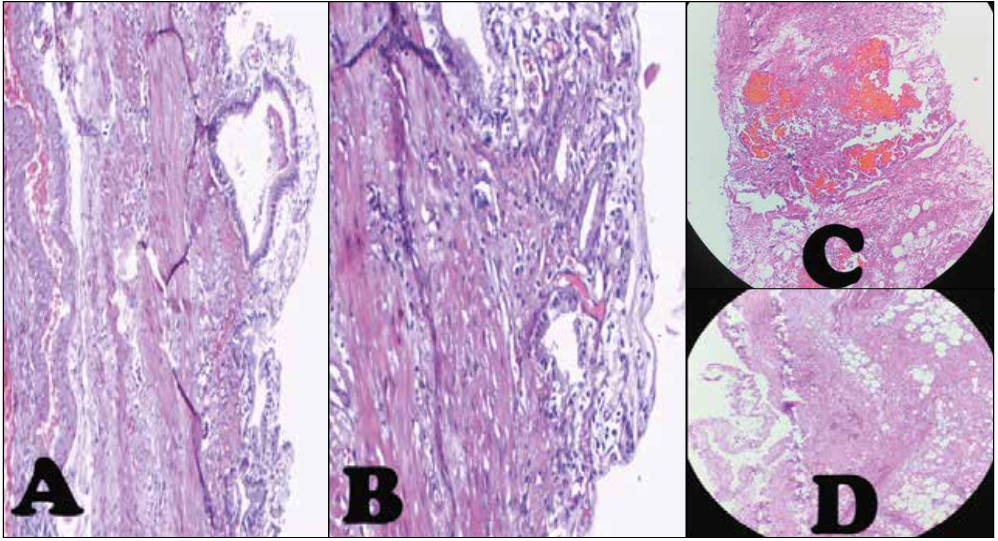
Figura 4.
Estudio histopatológico. Pared de vesícula biliar con mucosa erosionada y con exudado inflamatorio tipo linfocitario y neutrofílico. A y D, Aumento 100X, B Aumento 200X, C, Zonas de hemorragia y necrosis.
El paciente solo presentó dolor en CSD asociado a náuseas y vómitos [20,29]. Pero hubo una caída de dos puntos de hemoglobina; con marcadores de colestasis elevados inicialmente, pero con disminución espontánea de la bilirrubina, persistiendo elevados FA y GGTP.
La ecografía abdominal es la primera prueba para detectar la CH [27], siendo necesario un ecografista experimentado [4]. Los hallazgos incluyen engrosamiento focal de la pared, membranas intraluminales y material ecogénico intraluminal inmóvil y sin sombras [2,9,12,13,15,19]. También, el contenido con niveles ecogénicos, que debe diferenciarse del barro biliar [27]. Si el contenido ecogénico no se asienta en el piso de la VB, puede ser difícil de distinguir de un carcinoma [27]. Dependiendo del estado de la sangre, puede aparecer como estratificada, aglomerada o adherida a la pared de la VB [18]; o puede progresar desde una apariencia sólida a una mixta, y finalmente, una apariencia quística, a medida que los coágulos se lisan y se vuelven líquidos [27]. Los indicios de perforación son: el desinflado de la VB, con pérdida de su forma normal y una acumulación focal de líquido pericolequístico [18].
La TC es la mejor herramienta para evaluar la CH, posibles causas y complicaciones [27]. Puede mostrar hiperdensidad y engrosamiento de pared vesicular, conteniendo niveles de líquido hiperdensos en capas y aumento de la densidad biliar (como "leche de calcio"), sugiriendo la presencia de sangre dentro de la VB [1,8,12,15]. La hemobilia además, se puede identificar como un material hiperdenso intravesicular, a veces con un nivel de hematocrito [27]. La TC puede evidenciar hemoperitoneo (signo de perforación) o hematomas subcapsulares o perihepáticos (por la extensión del sangrado) [27]. Además, la TC trifásica, en fase temprana (o arterial) puede evidenciar la extravasación activa de contraste [1,2]; también, puede revelar otras anomalías asociadas, como malformaciones vasculares [27]. La angiotomografía puede ser un complemento útil cuando existe la sospecha de una fuente alternativa de hemorragia [2]; es de elección en pacientes inestables con afectación potencialmente mortal [3].
La resonancia magnética es útil en pacientes con síntomas o complicaciones graves, hallazgos no concluyentes, en sospecha de coledocolitiasis, o en mujeres embarazadas. Los coágulos de sangre y la hemorragia pueden mostrarse como defectos o lesiones de baja intensidad de señal (hipointensos) en T2, causando la falta de visualización de la VB o los conductos biliares [27], diferente a las señales hiperintensas en CA o masas intravesiculares [31].
Cuando hay hemobilia, la CPRE puede confirmar o descartar cálculos dentro del tracto biliar, pero no puede eliminar la posibilidad de cálculos previos que ya han pasado [12], situación que pudo haber pasado en nuestro caso, ya que hubo una caída espontánea de los marcadores de colestasis.
En nuestro caso fue necesario realizar inicialmente una tomografía [2,9,13,15,16,19,30], y endoscopía [2,10,29], para descartar patología tumoral (motivo de la referencia). Finalmente fue la colangioresonancia [2,10,29] y la caída de hemoglobina, lo que confirmó la sospecha y generó su intervención. Durante la cirugía se evidenció una vesícula gangrenada con coágulos y cálculos en su interior [9,14,20], confirmándose el diagnóstico con la histopatología.
El tratamiento inicial se centra en la reanimación del paciente, incluida la reversión de cualquier coagulopatía iatrogénica o patológica [19]. Independientemente de la causa, la cirugía sigue siendo el estándar de oro para el tratamiento [15,16,27], siendo necesaria una colecistectomía urgente, por laparoscopía o laparotomía, para prevenir la perforación [7,27], siendo el mejor momento las primeras 72h [7], sobre todo cuando se produjo por terapias anticoagulantes [1,17].El tratamiento depende de los síntomas y el estado general del paciente [12]. En pacientes que no son candidatos a cirugía o con comorbilidades importantes, la colocación percutánea de una sonda de colecistostomía es una opción [12,13,15,18,19], aunque la misma, no está indicada en presencia de gangrena o perforación vesicular [7]. Por lo tanto, los retrasos en el tratamiento de la colecistitis, ya sea quirúrgicamente o mediante colecistostomía percutánea, pueden progresar a una CH que puede resultar en una mayor morbilidad y mortalidad [2]. Además, en pacientes que presenten ictericia obstructiva, se requerirá una CPRE urgente antes de proceder a la colecistectomía [15].
En conclusión, la CH es rara, y sus complicaciones son a menudo fatales. Clínicamente es idéntica a la CA, y no suele presentarse con hemorragia gastrointestinal. Debe considerarse en pacientes con antecedentes de terapia anticoagulante, trauma, malignidad o críticamente enfermos. Pero puede presentarse en pacientes sin antecedentes y estar asociado a colelitiasis. El diagnóstico temprano de esta complicación potencialmente fatal es importante para facilitar el manejo quirúrgico urgente, siendo el apoyo imagenológico necesario para su sospecha.
REFERENCIAS BIBLIOGRÁFICAS
1. Kwon J-N. Hemorrhagic cholecystitis: report of a case. Korean J Hepatobiliary Pancreat Surg. 2012;16(3):120. doi: 10.14701/ kjhbps.2012.16.3.120.
2. Lauria AL, Bradley MJ, Rodriguez CJ. Hemorrhagic Cholecystitis: An Uncommon Disease Resulting in Hemorrhagic Shock. Am Surg. 2019;85(6):279-281. doi: 10.1177/000313481908500603.
3. López V, Alconchel F. Hemorrhagic cholecystitis. Radiology. 2018;289(2):316. doi: 10.1148/radiol.2018181161.
4. Aldohayan NA, Rashed A Al, Aljurayyan R. Hemorrhagic cholecystitis with auto-avulsion. Radiol Case Reports. 2021;16(12):3739-3743. doi: 10.1016/j.radcr.2021.08.063.
5. Nitta T, Iida R, Ishii M, Ueda M, Senpuku S, Matsutani A, et al. Emergency laparoscopic cholecystectomy for hemorrhagic cholecystitis: A case report. Int J Surg Case Rep. 2021;89(November):106631. doi: 10.1016/j.ijscr.2021.106631.
6. Bolívar-Rodríguez MA, Cázarez-Aguilar MA, Fierro-López R, Morales- Ramírez C. Colecistitis hemorrágica: reporte de caso y revisión de la literatura. Rev cir. 2019;18(91):70-74. doi:10.24875/j.gamo. m18000141.
7. Bombón F, Jumbo J, Carrión L. Colecistitis hemorrágica, a propósito de un caso. Rev Univ MEDICIENCIAS. 2020;4(1):21-27. doi: https:// doi.org/10.31243/mdc.uta.v5i1.
8. Chen Y-Y, Yi C-H, Chen C-L, Huang S-C, Hsu Y-H. Hemorrhagic cholecystitis after anticoagulation therapy. Am J Med Sci. 2010;340(4):338-339. doi: 10.1097/MAJ.0b013e3181e9563e.
9. Sweeny A, Smith NA, Serfin JA. Hemorrhagic cholecystitis causing hemobilia and common bile duct obstruction. J Surg Case Reports. 2019;2019(3):1-3. doi: 10.1093/jscr/rjz081.
10. Chang CW, Wu YH, Liu HL. Upper Gastrointestinal Bleeding With Hemobilia Caused by Gallstones. J Emerg Med. 2020;58(5):e227-e229. doi: 10.1016/j.jemermed.2020.03.035.
11. Berry R, Han J, Girotra M, Tabibian JH. Hemobilia: Perspective and role of the advanced endoscopist. Gastroenterol Res Pract. 2018;2018:doi: 10.1155/2018/3670739.
12. Parekh J, Corvera C. Hemorrhagic cholecystitis. Arch Surg. 2010;145(2):202-204. doi: 10.1001/archsurg.2009.265.
13. Hasegawa T, Sakuma T, Kinoshita H, Nakagawa Y, Kawachiya T, Hara J, et al. A case of hemorrhagic cholecystitis and hemobilia under anticoagulation therapy. Am J Case Rep. 2021;22(1):e927849- 1-e927849-6. doi: 10.12659/AJCR.927849.
14. Khoury G, Nicolas G, Abou-Jaoude EA, Emmanuel N, Awdeh A, Bitar B, et al. An intra-operatively diagnosed case of hemorrhagic cholecystitis in a 43-year-old patient: Case report. Am J Case Rep. 2019;20:1732-1735. doi: 10.12659/AJCR.915999.
15. Ng ZQ, Pradhan S, Cheah K, Wijesuriya R. Haemorrhagic cholecystitis: A rare entity not to be forgotten. BMJ Case Rep. 2018;2018:3-5. doi: 10.1136/bcr-2018–226469.
16. Espino PC, Cabezas MDC, Cubedo EJ, de la Poza JLL, Turrión VS. Perforated hemorrhagic cholecystitis. Cir Esp. 2015;94(2):e35-e36. doi: 10.1016/j.ciresp.2015.03.016.
17. Khan Hotak M, Joseph C. A case of haemorrhagic cholecystitis with no risk factors. J Surg Case Reports. 2021;2021(12):1-3. doi:10.1093/jscr/rjab542.
18. Reens D, Podgorski B. Hemorrhagic Cholecystitis: A Case of Expedited Diagnosis by Point-of-Care Ultrasound in the Emergency Department. J Emerg Med. 2019;57(1):74-76. doi: 10.1016/j. jemermed.2019.03.010.
19. Kinnear N, Hennessey DB, Thomas R. Haemorrhagic cholecystitis in a newly anticoagulated patient. BMJ Case Rep. 2017;2017:2016- 2018. doi: 10.1136/bcr-2016–214617.
20. García Pérez R, Ruiz de Angulo D, López Poveda MJ, Febrero Sánchez B, Navas Carillo D, Parrilla Paricio P. Colecistitis hemorrágica y hemofilia : dos complicaciones infrecuentes del lupus eritematoso sistémico. Rev Esp Enferm Dig. 2011;103(8):431-433. doi: 10.4321/ S1130-01082011000800009.
21. Khan SM, Emile SH, Barsom SH, Naqvi SAA, Khan MS. Accuracy of pre-operative parameters in predicting severe cholecystitis-A systematic review. Surgeon. 2021;19(4):219-225. doi: 10.1016/j. surge.2020.06.010.
22. Auda A, Al Abdullah R, Khalid MO, Alrasheed WY, Alsulaiman SA, Almulhem FT, et al. Acute Cholecystitis Presenting With Septic Shock as the First Presentation in an Elderly Patient. Cureus. 2022;14(1):6-11. doi: 10.7759/cureus.20981.
23. Maddu K, Phadke S, Hoff C. Complications of cholecystitis: a comprehensive contemporary imaging review. Emerg Radiol. 2021;28(5):1011-1027. doi: 10.1007/s10140-021-01944-z.
24. Bouassida M, Madhioub M, Kallel Y, Zribi S, Slama H, Mighri MM, et al. Acute Gangrenous Cholecystitis: Proposal of a Score and Comparison with Previous Published Scores. J Gastrointest Surg. 2021;25(6):1479-1486. doi: 10.1007/s11605-020-04707–2.
25. Parza K, Patel P, Scibelli N, Sansbury JR. Occult Perforated Gangrenous Gallbladder Found on Magnetic Resonance Cholangiopancreatography. Cureus. 2021;13(6):e15754. doi: 10.7759/cureus.15754.
26. Inoue H, Ochiai T, Kubo H, Yamamoto Y, Morimura R, Ikoma H, et al. Laparoscopic cholecystectomy for gangrenous cholecystitis in around nineties: Two case reports. World J Clin Cases. 2021;9(14):3424-3431.doi: 10.12998/wjcc.v9.i14.3424.
27. Ramírez Calderón JZ, Martínez Chamorro E, Ibáñez Sanz L, Albillos Merino JC, Borruel Nacenta S. Hemorrhagic cholecystitis: ultrasound and CT imaging findings—a retrospective case review series. Emerg Radiol. 2021;28(3):613-620. doi: 10.1007/s10140- 020-01879–x.
28. Seok DK, Ki SS, Wang JH, Moon ES, Lee TU. Hemorrhagic cholecystitis presenting as obstructive jaundice. Korean J Intern Med. 2013;28(3):384-385. doi:10.3904/kjim.2013.28.3.384.
29. Staszak JK, Buechner D, Helmick RA. Cholecystitis and hemobilia. J Surg Case Reports. 2019;2019(12):1-3. doi: 10.1093/jscr/rjz350.
30. Zhang X, Zhang C, Huang H, Wang J, Zhang Y, Zhang Y, et al. Hemorrhagic cholecystitis with rare imaging presentation: A case report and a lesson learned from neglected medication history of NSAIDs. BMC Gastroenterol. 2020;20(172):1-5. doi: 10.1186/ s12876-020-01312–0.
31. Nguyen D, Goodwin JS, Bhowmik N, Boiteau G, Potts J. Acute Hemorrhagic Cholecystitis with Large Hemoperitoneum: Treatment with Microcoil Embolization and Subsequent Cholecystectomy. J Radiol Case Rep. 2021 Feb 28;15(2):25-34. doi: 10.3941/jrcr. v15i2.3901.
Notas de autor
angel.veraportilla218@gmail.com